줄기세포의 노화는 수명연장에 지대한 영향을 미칠 뿐만 아니라 피부에 미치는 영향 또한 크다고 할 수 있습니다. 또한 줄기세포를 연구 하는것은 수명연장과 피부를 젊게 만들고 상피세포를 복구하며, 혈관을 새로이 만들어 혈액을 개선합니다. 이러한 연구는 인류 모두에게 해택을 가져온다 할 것입니다.
줄기세포 능력
- 자가재생능력 : 조직복구
- 다방향 분화 : 조직 향상성 유지
- 줄기세포 고갈 : 신체노화 및 노화 관련 질환 발생
연구된 대표적 치료분야
- 화상
- 피부손상
수명연장을 방해하는 줄기세포 노화 원인 9가지
- 세포노화(Cellular Senescence)
- 텔로미어와 텔로머라제(Telomere and Telomerase)
- DNA 손상 및 돌연변이(DNA Damage and Mutations)
- 후생적 변화Epigenetic Alterations
- 비코딩 RNANon-coding RNA
- SIRT 단백질 계열SIRT Family of Proteins
- 영양소 감지 및 대사Nutrient Sensing and Metabolism
- 세포 극성 및 단백질 항상성Cell Polarity and Proteostasis
- 틈새 환경 악화Niche Deterioration
대표적인 줄기세포 치료
조혈모세포 이식 (Hematopoietic Stem Cell Transplantation, HSCT)
HSCT는 특히 백혈병, 림프종, 일부 빈혈 유형, 그리고 면역 체계 장애와 같은 질환에 효과적입니다. 그러나 이 치료법은 심각한 부작용을 일으킬 수 있으며, 모든 환자에게 적합한 것은 아닙니다. HSCT의 성공 여부는 다양한 요인, 예를 들어 환자의 건강 상태, 이식된 조혈줄기세포의 출처, 기증자와의 호환성 등에 의해 영향을 받습니다.
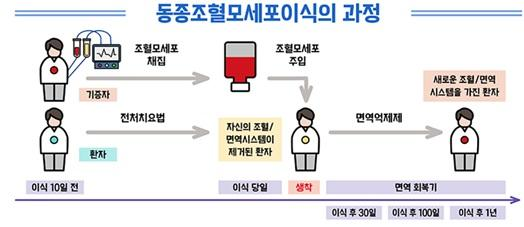
조혈줄기세포의 획득
- 조혈줄기세포는 환자 자신(자가 이식) 또는 호환 가능한 기증자(동종 이식)로부터 얻어질 수 있습니다.
- 이 세포들은 주로 골수, 말초 혈액, 또는 제대혈에서 추출됩니다.
조건화 요법
- 이식 전에 환자는 조건화 요법을 받습니다. 이는 고용량의 화학 요법 또는 방사선 요법을 포함하여, 기존의 병든 혈액 세포를 제거하고 면역 체계를 억제하는 과정입니다.
이식
- 준비된 조혈줄기세포는 정맥을 통해 환자에게 주입됩니다.
- 주입된 세포들은 환자의 골수로 이동하여 건강한 혈액 세포의 생성을 시작합니다.
회복 및 모니터링
- 이식 후 몇 주 동안, 새로운 조혈줄기세포가 건강한 혈액 세포를 생성하기 시작할 때까지 환자는 감염 위험에 취약합니다.
- 이 기간 동안 환자는 정기적인 모니터링과 지원 치료를 받습니다.
중간엽줄기세포 (Mesenchymal Stem Cells, MSCs) 치료
MSCs 치료는 재생 의학의 중요한 분야로, 그 잠재력은 지속적인 연구를 통해 더욱 확장될 것으로 기대됩니다. 이 치료법은 다양한 조직 및 장기 손상에 대한 효과적인 치료 옵션을 제공할 수 있는 가능성을 가지고 있습니다.
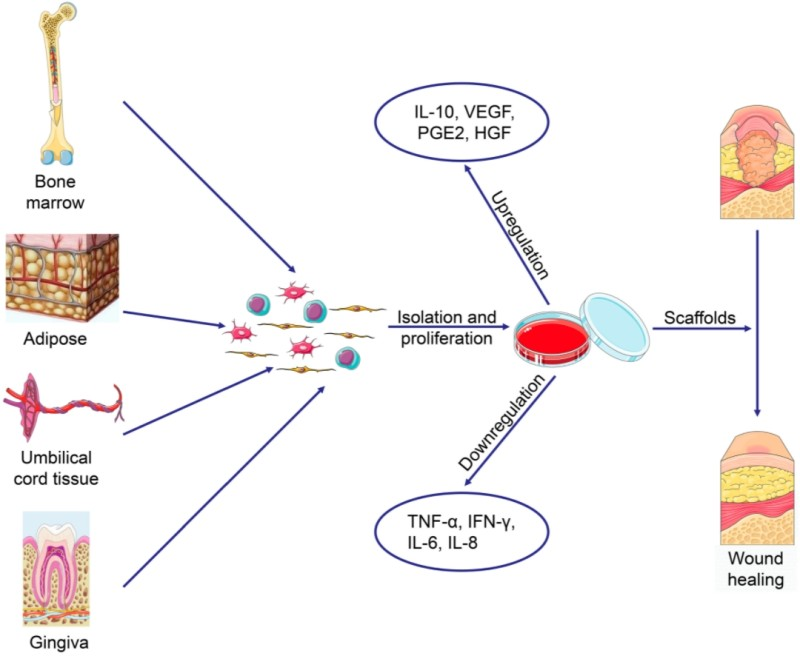
치료의 메커니즘
- MSCs는 다양한 유형의 세포로 분화할 수 있는 능력을 가지고 있어, 손상된 조직의 복구 및 재생에 기여할 수 있습니다.
- 염증을 감소시키고 조직 치유를 촉진하는 다양한 생물학적 활성 분자를 분비합니다.
적용 범위
- 골 및 연골 조직: 골절 치유, 골관절염 및 기타 골격계 질환의 치료에 MSCs가 사용됩니다.
- 근육 조직: 근육 손상 및 퇴행성 근육 질환의 치료에 적용됩니다.
- 신경 조직: 신경 손상, 신경 퇴행성 질환의 치료에 MSCs가 사용될 수 있습니다.
- 피부 조직: 만성 상처, 화상, 피부 재생에 MSCs가 활용됩니다.
- 심장 질환: 심장 근육의 손상 복구 및 심장 기능의 개선에 MSCs가 사용될 수 있습니다.
치료 방법
- MSCs는 주로 환자의 손상된 조직에 직접 주입되거나 정맥을 통해 주입됩니다.
- 이식된 MSCs는 해당 조직에서 활동하며, 조직의 복구 및 재생을 촉진합니다.
안전성 및 효과성
- MSCs 치료는 일반적으로 안전하며, 중대한 부작용의 위험이 낮습니다.
- 그러나 MSCs 치료의 효과와 장기적 안전성에 대한 추가적인 연구가 필요합니다.
피부 및 화상 치료
줄기세포를 이용한 피부 및 화상 치료는 여전히 발전 중인 분야이며, 치료의 효과와 안전성에 대한 추가 연구가 필요합니다. 그러나 초기 연구와 임상 시험 결과는 이러한 접근법이 피부 재생과 치유에 매우 유망할 수 있음을 알려줍ㄴ니다.
피부 재생
- 줄기세포는 손상된 피부 조직을 복구하고 새로운 피부 세포의 성장을 촉진하는 능력을 가지고 있습니다.
- 이는 화상, 상처, 피부 궤양 등으로 인한 손상된 피부의 치유 과정을 가속화하는 데 도움이 될 수 있습니다.
화상 치료
- 심각한 화상 환자의 경우, 줄기세포는 피부 재생을 도와 화상으로 인한 손상을 치유하고 흉터 형성을 최소화할 수 있습니다.
- 줄기세포는 피부의 깊은 층을 재건하고, 새로운 피부 세포의 성장을 촉진하며, 피부의 기능과 외관을 개선합니다.
노화 방지 및 미용 목적
- 줄기세포는 피부 노화의 징후를 감소시키고 피부의 탄력성과 질감을 개선하는 데 사용될 수 있습니다.
- 줄기세포 치료는 피부의 콜라겐 생성을 촉진하고, 주름을 감소시키며, 전반적인 피부 건강을 개선할 수 있습니다.
치료 절차
- 줄기세포는 환자의 피부에 직접 주입되거나, 피부에 적용되는 특수한 줄기세포 기반 크림 또는 젤 형태로 사용될 수 있습니다.
- 이러한 방식은 피부의 재생 과정을 자극하고 손상된 조직의 회복을 돕습니다.
신경계 질환 치료
신경계 질환 치료에 있어서 신경줄기세포의 활용은 중요한 가능성을 가지고 있습니다. 이러한 치료는 손상된 신경 조직을 복구하고, 새로운 신경 세포의 생성을 촉진하는 방식으로 이루어집니다.
신경줄기세포의 역할
- 신경줄기세포는 손상된 뇌 및 척수 조직에 적용될 때 새로운 신경 세포와 글리아 세포를 생성할 수 있는 능력을 가지고 있습니다.
- 손상된 신경 네트워크를 복구하고 신경 기능을 회복하는 데 중요한 역할을 할 수 있습니다.
적용 가능한 질환
- 파킨슨 병: 신경줄기세포는 파킨슨 병 환자에서 손상된 도파민 생성 뉴런을 대체할 수 있습니다.
- 알츠하이머 병: 신경줄기세포는 손상된 뇌 조직을 재건하고, 인지 기능을 개선하는 데 도움을 줄 수 있습니다.
- 척수 손상: 척수 손상으로 인한 신경 기능의 손실을 회복시키는 데 신경줄기세포가 사용될 수 있습니다.
- 뇌졸중: 뇌졸중 후 손상된 뇌 조직을 회복시키고, 신경 기능을 재활하는 데 신경줄기세포가 적용될 수 있습니다.
치료 방법
- 신경줄기세포는 환자의 손상된 신경 조직에 직접 주입되어, 손상된 부위의 신경 회복을 촉진합니다.
- 이 세포들은 손상된 신경세포를 대체하고, 새로운 신경 연결을 형성하며, 신경 보호 및 재생 활동을 수행합니다.
현재 상태와 전망
- 신경줄기세포 치료는 여전히 연구 및 개발 단계에 있으며, 많은 임상 시험이 진행 중입니다.
- 초기 연구 결과는 이 접근법이 신경계 질환 치료에 매우 유망할 수 있음을 보여줍니다.
당뇨병 치료
당뇨병, 특히 제1형 당뇨병의 치료에 있어서 줄기세포의 활용은 큰 가능성을 가지고 있습니다. 이러한 연구는 주로 췌장의 베타 세포를 재생하거나 대체하는 데 초점을 맞추고 있습니다:
베타 세포의 중요성
- 췌장의 베타 세포는 인슐린을 생산하고 분비하는 역할을 합니다.
- 제1형 당뇨병은 면역 체계가 이 베타 세포를 공격하여 파괴함으로써 발생합니다.
줄기세포를 활용한 베타 세포 재생
- 줄기세포, 특히 배아줄기세포나 유도만능줄기세포(iPSCs)는 췌장 베타 세포로 분화할 수 있는 능력을 가지고 있습니다.
- 이러한 세포들을 췌장에 이식함으로써, 손상된 베타 세포를 대체하고 새로운 인슐린 생산 세포를 생성할 수 있습니다.
치료의 잠재적 효과
- 성공적으로 이식된 줄기세포가 베타 세포로 분화하고 기능하게 되면, 이는 제1형 당뇨병 환자의 인슐린 의존성을 감소시킬 수 있습니다.
- 이는 당뇨병 관리에 혁신적인 접근법을 제공하며, 환자의 삶의 질을 크게 향상시킬 수 있습니다.
현재 연구 상태
- 줄기세포를 활용한 당뇨병 치료는 여전히 연구 및 개발 단계에 있으며, 여러 임상 시험이 진행 중입니다.
- 이 치료법의 효과와 장기적 안전성에 대한 평가가 필요합니다.
줄기세포가 피부에 미치는 영향
- 피부층 아래에 콜라겐을 재건하여 젊고 건강하게 보입니다.
- 상피 세포를 복구합니다.
- 혈관신생으로 새로운 혈관, 모세혈관 및 동맥의 생성을 도와 혈액을 개선하며, 이는 치유 및 자가 복구에 도움이 됩니다.
줄기세포 비용
- 1년 또는 18개월 반복시 수천달러가 소요
대표적인 줄기세포 치료 헐리웃스타들
해리 스타일스(Harry Styles), 마고 로비(Margot Robbie), 데이비드 베컴(David Beckham)
우리가 알아야 할 줄기세포 종류
- 배아 줄기세포(embryonic stem cells)
- 성체 줄기세포(adult stem cells)
- 유도 만능 줄기세포 (iPS cells)
배아줄기세포 (Embryonic stem cells)
배아의 초기 단계에서 추출되는 특별한 유형의 줄기세포입니다. 이 세포는 놀라운 재생 및 분화 능력을 가지고 있으며, 인간 발달의 가장 초창기 단계에서 발견됩니다. 다만 배아줄기세포 연구는 그 잠재력이 크지만, 사회 윤리적 측면에서 여러 문제가 제기 될 수 있으니 점차적이고 신중한 접근이 요구됩니다. 다만 도덕적인 면을 감안하여 차츰 연구와 응용을 진행하면, 이 분야만큼 재생 의학과 다양한 질병 치료에 크게 기여할 수 있는 연구는 없다는것은 분명합니다.
- 유래: 사람의 정자와 난자가 결합한 수정란에서 유래합니다.
- 분화 능력: 가장 중요한 특징 중 하나로 “신체의 어떤 유형의 세포로도 분화할 수 있는 ‘전능성'(Pluripotency)”을 가지고 있다는 것입니다. 신경세포, 심장세포, 근육세포, 피부세포 등 인체를 구성하는 약 2조 개의 다양한 세포 유형 중 어떤 것으로도 변화할 수 있음을 의미합니다.
- 의학적 중요성: 손상된 조직이나 기관을 복구하거나 대체하는 데 사용될 수 있으며, 다양한 질병의 치료와 연구에 활용될 수 있습니다.
- 윤리적, 법적 논의: 배아줄기세포 연구는 윤리적, 법적 문제로 인해 논란의 대상이 되기도 합니다. 배아의 사용과 관련된 윤리적 문제는 사회적, 종교적 관점에 따라 다양한 의견을 낳으며, 많은 국가에서 이와 관련된 엄격한 규제와 지침이 존재합니다.
성체줄기세포 (Adult Stem Cell/ Tissue-specific Stem Cell)
성인 신체의 다양한 조직에 존재하는 줄기세포 유형으로 주로 특정 조직의 복구와 유지에 중요한 역할을 하며, 각 조직의 특정한 세포 유형으로만 분화할 수 있다는 제한적인 특성을 가지고 있음에도 불구하고, 재생 의학과 조직 복구 분야에서 중요한 역할을 하고, 배아줄기세포와 다르게 더 적은 윤리적 문제를 수반한다는 장점이 있습니다. 이러한 특성으로 인해, 다양한 의학적 치료에 활용될 수 있는 매우 유용한 자원입니다.
- 존재 위치와 수량: 신체의 여러 조직에 소량으로 존재합니다. 해당 조직의 복구 및 재생 과정에서 중요한 역할을 하기 때문에 각 조직에 필요한 수준으로 유지됩니다.
- 분화 능력: 주로 자신이 속한 특정 조직의 세포 유형으로만 분화할 수 있는 ‘다능성'(Multipotency)을 가지고 있습니다. 예를 들어, 골수의 성체줄기세포는 다양한 유형의 혈구세포로 분화할 수 있지만, 다른 조직의 세포로 변화하는 능력은 제한적입니다.
- 응용 분야: 신체 조직의 복구와 재생에 활용 될수 있으며. 골수 이식에서 사용되는 혈액 형성 줄기세포는 혈액질환의 치료에 중요한 역할을 합니다. 또한, 다른 조직 특이적 성체줄기세포도 조직 손상의 치료와 관련된 연구에서 활용됩니다.
- 윤리적 문제: 성체줄기세포 연구는 배아줄기세포 연구와 다르게 윤리적으로 논란이 적 습니다. 이유는 성체줄기세포가 이미 발달된 개인으로부터 채취되기 때문에, 배아를 사용하는 것과 같은 관련된 윤리적 문제가 없습니다.
유도 만능 줄기세포 (Induced Pluripotent Stem Cells – iPS cells or iPSCs)
혁신적인 줄기세포 기술의 결과물로, 특정 유형의 성체 세포를 재프로그래밍하여 배아줄기세포와 유사한 전능성(pluripotency)을 가진 세포로 전환시킬 수 있습니다. 이 기술은 다양한 잠재적 응용분야를 가지고 있으며, 줄기세포 연구 분야에서 중요한 진보를 나타냅니다. 또한 iPS 세포 기술은 줄기세포 연구 분야에서의 중대한 발전을 대표하며, 미래의 의학에 큰 영향을 미칠 것으로 기대됩니다. 이 기술은 줄기세포의 잠재력을 새로운 차원으로 확장시키고, 많은 치료법의 개발에 기여할 수 있는 중요한 도구로 간주됩니다.
- 역분화 과정: iPS 세포는 성체 세포(예를 들어, 피부 세포나 혈액 세포)를 역분화시키는 과정을 통해 생성됩니다. 이 과정에서 세포는 특정 유전자가 활성화되어 원래의 ‘미분화’ 상태로 돌아가게 됩니다. 이러한 유전자는 세포의 전능성을 촉진하는 역할을 하며, 배아줄기세포와 유사한 특성을 가진 세포를 만들어냅니다.
- 전능성: 배아줄기세포처럼 신체의 어떤 유형의 세포로도 분화할 수 있는 능력을 가집니다. 이는 재생 의학과 조직 공학에서 매우 유용하게 사용될 수 있습니다.
- 윤리적 장점: iPS 세포 역시 배아를 사용하지 않기 때문에 배아줄기세포 연구와 관련된 윤리적 문제를 피할 수 있습니다.
- 응용 분야: 재생 의학, 질병 모델링, 약물 테스트 등 다양한 분야에서 응용되며, 특히, 환자 자신의 세포로부터 iPS 세포를 생성함으로써 개인 맞춤형 치료 방법을 개발하는 데 큰 잠재력을 가지고 있습니다.
수명연장의 비밀 성체줄기세포(Adult Stem Cell/ Tissue-specific Stem Cell)
성체줄기세포는 인체 내 다양한 조직과 기관에서 발견되며, 각기 다른 역할을 수행합니다. 이들의 주요 특징과 기능은 다음과 같습니다
다양한 유형의 성체줄기세포
- 중간엽줄기세포(MSC): 골수, 지방, 근육, 양수, 제대혈 등 다양한 곳에서 발견되며, 다양한 조직으로 분화할 수 있습니다.
- 조혈줄기세포(HSC): 혈액 세포를 생성하며, 주로 골수에서 발견됩니다.
- 신경줄기세포(NSC): 신경계의 세포를 생성합니다.
- 간줄기세포(LSC): 간 조직의 재생에 중요합니다.
- 근육위성세포(MuSC): 근육 조직의 복구와 재생에 기여합니다.
- 표피줄기세포(SESC), 장상피줄기세포(IESC), 망막줄기세포(RSC), 생식줄기세포(GSC), 췌장줄기세포(PSC) 등도 각각 특정 조직과 관련된 세포로 분화합니다.
중간엽줄기세포(MSC)의 중요성
- MSC는 그들의 다분화 잠재력과 자가 재생 능력으로 인해 주목받고 있습니다.
- 시험관 내에서 배양하기 쉬우며, 숙주 세포와의 상호작용과 면역 내성이 뛰어납니다.
- 이러한 특성으로 인해 재생 조직 공학 및 다양한 질병 치료에 이상적인 세포로 간주됩니다.
성체줄기세포의 공통 특징
- 자가 재생 능력: 텔로머라제를 발현하여 자신을 유지하고 복제할 수 있습니다.
- 정적/활성 상태 사이의 전환: 활성 상태와 정지 상태 사이를 전환하여, 필요에 따라 활성화될 수 있습니다.
- 염색질 상태: 재생 또는 분화를 위해 다양한 상태로 존재합니다.
- 대사 요구 사항: 특정 조건 하에서 최적으로 기능하기 위한 독특한 대사 과정을 가지고 있습니다.
- 비대칭적 세포분열: 세포 내 거대분자 물질의 비대칭적 분포로 인해 비대칭적인 세포분열을 일으킵니다.
수명연장을 방해하는 줄기세포 노화 원인 9가지
세포노화(Cellular Senescence)
세포 노화는 세포의 수명을 제한하는 과정입니다. 이 과정은 세포 주기가 불 규칙적이며 세포의 죽음이 억제되면서 발생합니다. 여기에는 몇 가지 주요 요소가 관여합니다. 간단히 말해, 세포 노화는 세포의 기능을 방해하고, 노화 과정을 전진 하게하는 여러 메커니즘을 포함합니다. 이러한 원인으로 줄기 세포의 기능 0이 감소하고, 주변 세포와 조직에 영향을 미처 노화를 촉진합니다.
종양 억제 경
세포 노화의 중요한 기초를 형성합니다. p16INK4A 같은 단백질은 나이가 들수록 세포 내에 축적되며, 이를 억제하면 노화된 줄기 세포의 기능을 개선할 수 있습니다.
비노화 세포에 영향
노화 세포는 염증성 사이토카인, 케모카인, 성장 인자, 매트릭스 금속단백분해효소를 포함하는 SASP(Senescence-Associated Secretory Phenotype)를 분비합니다. 이 분비물은 주변의 비노화 세포에 영향을 미쳐 노화를 촉진할 수 있으며, 주변 세포에 만성 염증을 유발합니다.
엑소좀과 세포외 소포 (EV)
노화 세포는 엑소좀을 포함한 세포외 소포를 분비합니다. 단백질, 지질, DNA, RNA 등을 포함하며, 주변 세포에 영향을 미쳐 세포 노화를 촉진할 수 있습니다.
miRNA
RNA 침묵 및 유전자 발현 조절에 중요한 작은 비코딩 RNA 분자입니다. 노화된 줄기 세포는 변경된 miRNA를 포함하는 엑소좀을 방출합니다. 이러한 miRNA는 세포 사멸을 억제하고, 세포 노화, 줄기 세포 수 감소, 텔로미어 침식 등을 조절하여 조직 특이적 줄기 세포 기능의 저하에 영향을 미칩니다.
텔로미어와 텔로머라제(Telomere and Telomerase)
텔로미어와 텔로머라제의 반복 횟수와 길이는 세포 노화와 깊숙한 관련이 있으며, 또한 줄기세포의 기능 저하에 중요한 역할을 합니다. 왜 길이와 반복이 제한되어 있는지등의 연구는 줄기세포 기반 치료의 발전에 중요한 핵심 정보를 제공 할 수 있습니다.
텔로미어의 역할
- 텔로미어는 염색체의 끝에 위치한 반복 DNA 서열로 구성되며, 세포의 복제와 보호 역할을 합니다.
- 세포 분열이 진행됨에 따라 텔로미어는 점차 짧아지며, 한계에 달하면 세포는 노화 됩니다.
- 텔로미어가 너무 짧아지면 DNA 복제가 불가능해지고, 이는 세포 분열 정체와 세포의 죽음을 초래할 수 있습니다.
텔로머라제의 기능
- 텔로머라제는 텔로미어의 길이를 유지하고 복구하는 역할을 하는 효소입니다.
- 세포 분열로 인한 텔로미어의 손실을 방지하는 데 중요하지만, 노화하는 동안 줄기 세포의 텔로미어는 여전히 짧아질 수 있습니다.
노화와 텔로미어/텔로머라제의 관계
- 텔로머라제의 활성화는 텔로미어의 길이를 늘리고 세포의 수명을 연장시킬 수 있습니다.
- 텔로미어의 길이는 세포노화와 생존에 영향을 미치며, 긴 텔로미어는 일반적으로 생물에 있어서 더 긴 수명과 연관됩니다.
- MSC에서 텔로머라제의 활성은 텔로미어 길이를 늘리고, 세포 증식을 촉진하며, 세포의 죽음을 감소시킬 수 있습니다.
후생적 변화와 텔로미어 완전성
- 텔로미어 완전성은 텔로미어 길이뿐만 아니라 텔로미어와 서브텔로미어 영역의 후생적 상태에도 의존합니다.
- GADD45a는 짧은 텔로미어/서브텔로미어 영역에서 DNA 손상 반응을 조절하며, 이의 고갈은 텔로미어 길이를 조절하는 데 영향을 미칠 수 있습니다.
DNA 손상 및 돌연변이(DNA Damage and Mutations)
DNA 손상과 돌연변이의 축적은 줄기세포의 노화 과정과 밀접하게 관련되어 있습니다. 이는 세포의 증식, 생존, 그리고 기능에 영향을 미칩니다. 이러한 이해는 노화 과정을 조절하고 줄기세포 기반 치료법을 개발하는 데 중요한 기초를 제공합니다.
DNA 손상의 축적
- 히스톤 H2AX의 인산화와 혜성 꼬리 현상은 DNA 손상의 징후로, 특히 HSC(조혈줄기세포) 및 위성 세포에서 나이가 들면서 증가합니다.
- 노화된 HSC는 복제 스트레스와 DNA 헬리카제 발현 감소를 보여, DNA 복제 시 오류가 발생하기 쉽습니다.
돌연변이 축적의 영향
- 줄기세포의 DNA 복제 과정 중 발생하는 돌연변이는 암 발생 위험을 증가시킬 수 있습니다.
- 증식하는 줄기세포는 보다 정확한 DNA 복구 메커니즘을 사용하지만, 휴면 상태의 줄기세포는 더 오류가 발생하기 쉬운 복구 방법을 사용합니다.
DNA 손상 반응(DDR)의 역할
- DDR은 세포의 게놈 불안정성을 증가시켜 노화를 촉진할 수 있습니다.
- DDR을 통해 발생한 손상이 적절히 복구되지 않으면 세포 노화와 세포사멸이 발생할 수 있습니다.
DNA 손상의 장기적 영향
- 연구에 따르면, 노화 과정에서 전암성 돌연변이를 가진 HSC의 수가 증가하며, 이는 줄기세포 수의 감소, 세포사멸 또는 분화를 유도할 수 있습니다.
- DNA 복구 메커니즘 강화를 통해 수명 연장이 가능하며, 이는 줄기세포의 생존율과 관련이 있을 수 있습니다.
게놈 산화 스트레스와 AKT/TOR 신호전달 경로의 역할
- 누적된 DNA 손상은 내인성 IFNβ를 유도하고, 관련 신호 경로를 통해 DDR을 증폭시킬 수 있습니다.
- 초파리의 장 세포에서 연령과 관련된 이색질 안정성의 상실은 게놈 산화 스트레스 및 AKT/TOR 신호 전달 경로의 활성화와 관련이 있습니다.
후생적 변화(Epigenetic Alterations)
후생적 조절은 DNA 메틸화, 히스톤 변형, 염색질 리모델링, 비암호화 RNA 등을 포함합니다. 이러한 변화들은 줄기세포의 유전자 발현과 기능에 영향을 주며, 노화 과정을 촉진하거나 억제할 수 있습니다.
노화 과정에서 이러한 후생적 변화들은 줄기세포의 기능적 능력을 감소시키고, 유전자 발현의 변화를 유발하며, 최종적으로 줄기세포의 노화와 관련된 여러 병리학적 상태를 촉진할 수 있습니다. 이러한 변화를 이해하고 조절하는 것은 줄기세포 기반 치료와 노화 연구에 중요한 정보를 제공할 수 있습니다.
DNA 메틸화
- DNA 메틸화는 유전자 발현의 중요한 조절 메커니즘으로, CpG 섬의 메틸화를 통해 발현을 조절합니다.
- 노화된 HSC에서는 DNA 메틸화 수준의 변화가 관찰되며, 이는 유전자 발현에 영향을 미칩니다.
- DNMT3a와 DNMT3b는 메틸화 과정에 관여하는 효소로, 이들의 결핍은 HSC의 자가 재생 능력에 영향을 미칠 수 있습니다.
히스톤 변형
- 히스톤 변형은 유전자 발현 조절에 중요하며, 메틸화, 아세틸화, 인산화 등 다양한 형태가 있습니다.
- 노화 과정에서 히스톤 변형의 변화가 관찰되며, 이는 줄기세포의 기능과 수명에 영향을 미칩니다.
염색질 리모델링
- 염색질 리모델링은 유전자 발현 조절에 중요한 역할을 합니다.
- 노화 과정에서 염색질 구조의 변화가 관찰되며, 이는 줄기세포의 기능에 영향을 미칩니다.
비코딩(RNANon-coding RNA)
비코딩 RNA는 단백질을 코딩하지 않는 RNA 분자로, 이러한 비코딩 RNA들은 줄기세포의 노화 과정에서 중요한 조절자로 작용하며, 세포의 기능과 수명에 영향을 미칩니다.
miRNA
- miRNA는 유전자 발현을 조절하며, 줄기세포의 운명과 노화 과정에 중요한 역할을 합니다.
- 예를 들어, miR-206은 Pax3를 조절하여 근육 줄기세포의 활성화를 조절하고, let-7은 HMGA2의 하향 조절을 중재하여 성체 줄기 세포의 자가 재생을 촉진합니다.
- miR-34a, miR-29, miR-195 등은 줄기세포의 노화 과정과 연관되어 있으며, 이들의 발현 변화는 세포의 증식, 분화 및 노화에 영향을 미칩니다.
lncRNA
- lncRNA는 긴 비코딩 RNA로, 유전자 발현의 조절과 염색질 구조의 조절에 중요한 역할을 합니다.
- BMNCR, ZEB2-NAT 등은 줄기세포의 분화와 노화 과정에 영향을 미치며, 이들의 조절은 줄기세포의 운명 결정에 중요합니다.
- HOTAIR와 같은 lncRNA는 줄기세포의 노화와 관련된 유전자 발현 및 DNA 메틸화 프로파일의 변화에 기여합니다.
SIRT 단백질 계열(SIRT Family of Proteins)
SIRT 단백질 계열은 세포의 노화 과정과 밀접하게 관련된 히스톤 데아세틸라제 및 ADP-리보실트랜스퍼라제로, 주로 염증, 에너지 대사 및 노화 조절에 관여합니다. 각 SIRT 단백질은 독특한 기능을 가지고 있으며, 이러한 SIRT 단백질들의 조절은 줄기세포의 노화, 증식, 분화 및 세포 사멸 과정에 직접적인 영향을 미칩니다.
SIRT1
- SIRT1은 중간엽 줄기세포(MSC)의 증식과 분화를 유지하며 노화를 조절하는 데 중요한 역할을 합니다.
- SIRT1의 활성 감소는 세포의 노화를 촉진하며, p16과 p21의 발현을 조절할 수 있습니다.
- 레스베라트롤과 같은 SIRT1 활성화 물질은 MSC의 자가 재생 능력과 분화 능력을 향상시키고 세포 노화를 감소시킬 수 있습니다.
SIRT2, SIRT3, SIRT6
- SIRT3의 과발현은 산화 스트레스로 인한 손상을 개선하고 세포 사멸을 감소시킵니다.
- SIRT6은 DNA 손상 복구에 관여하여 게놈 안정성을 유지하며, 그 결핍은 세포 노화를 촉진할 수 있습니다.
영양소 감지 및 대사(Nutrient Sensing and Metabolism)
칼로리 제한, 대사 상태, ROS(활성 산소종) 수준 등은 줄기세포의 노화와 밀접하게 관련되어 있습니다. 영양소 감지 및 대사 조절은 줄기세포의 기능을 유지하고, 노화를 지연시키며, 잠재적으로 수명을 연장하는 전략으로 사용될 수 있습니다.
칼로리 제한의 영향
- 칼로리 제한은 줄기세포의 표현형 변화를 통해 수명을 연장할 수 있습니다.
- 이는 에너지 대사 경로를 조절하여 세포 손상을 줄이고, 줄기세포의 정상적인 틈새를 유지함으로써 기능과 조직의 항상성을 촉진합니다.
- 근육 내 위성 세포, HSC, GSC 등 다양한 줄기세포의 기능이 칼로리 제한을 통해 개선될 수 있습니다.
대사 상태와 ROS의 역할
- 산화 스트레스 손상은 ROS 생성을 증가시켜 세포 손상과 노화를 유발할 수 있습니다.
- MSC에서 ROS 수준의 증가는 증식 및 분화 능력을 손상시킬 수 있으며, 항산화제는 이러한 노화 현상을 감소시킬 수 있습니다.
- ROS와 이온화 방사선은 DNA 손상을 유발하고 세포 노화를 촉진할 수 있습니다.
줄기세포의 대사 경로
- 줄기세포는 저산소 환경에서 산화적 인산화에 크게 의존하여 에너지를 생성합니다.
- 줄기세포의 미토콘드리아 수 감소는 노화와 관련된 기능 변화를 일으킬 수 있습니다.
- 활성화된 줄기세포는 포도당과 글루타민 대사를 증가시켜 에너지를 효율적으로 생성합니다.
세포 극성 및 단백질 항상성(Cell Polarity and Proteostasis)
줄기세포는 단백질 항상성을 유지하고 손상된 성분의 축적을 방지하기 위해 다양한 메커니즘을 활용합니다. 이러한 메커니즘은 세포 극성, 비대칭 분열, 자가포식, 프로테아좀 활성 등을 포함하며, 줄기세포의 노화와 밀접하게 관련되어 있습니다. 단백질 항상성을 유지하고 손상된 성분을 효과적으로 제거하는 능력은 줄기세포의 노화를 지연시키고 장기적으로 건강한 기능을 유지하는 데 핵심적인 역할을 합니다.
비대칭 분열
- 줄기세포는 대칭적 또는 비대칭적으로 분열할 수 있으며, 비대칭 분열은 딸줄기세포와 분화된 세포를 생성합니다.
- 이 과정에서 손상된 단백질과 미토콘드리아는 비대칭적으로 분리되어, 자손줄기세포가 더 건강한 성분을 유지할 수 있도록 합니다.
- 극성의 상실은 노화된 줄기세포의 기능 감소와 관련이 있습니다.
프로테아좀 활성 및 자가포식
- 줄기세포는 프로테아좀 활성과 자가포식을 통해 손상된 단백질을 제거합니다.
- 특히, 줄기세포는 휴식기 동안 자가포식을 활성화하여 세포 내 노폐물을 제거하며, 이는 줄기세포의 건강과 수명에 중요합니다.
- 자가포식 손상과 줄기 세포 고갈 및 노화 사이의 상관관계가 여러 연구에서 입증되었습니다.
틈새 환경 악화(Niche Deterioration)
줄기 세포 틈새의 노화는 주로 외인성 메커니즘에 의해 주도됩니다. 노화된 줄기세포 미세환경은 세포 운명에 영향을 미치며, 여러 연구를 통해 입증되었습니다. 이러한 연구 결과는 줄기 세포 미세환경의 변화가 줄기세포의 노화에 미치는 영향을 입증하며, 줄기세포 기능 및 노화 연구에 중요한 정보를 제공합니다.
미세환경의 영향
- 노화 후, 지지 세포는 줄기 세포에 적절한 형태 형성 및 성장 인자 신호를 보낼 수 없게 됩니다.
- FGF와 같은 성장 인자의 변화는 줄기세포의 자가 재생에 영향을 미칠 수 있습니다.
- 염증 표지자의 증가와 생체시계의 변화도 줄기세포의 미세환경에 영향을 미치며, 이는 줄기세포의 기능에 부정적인 영향을 미칠 수 있습니다.
순환인자의 변화
- 순환인자의 농도 변화, 특히 인슐린과 IGF-1과 같은 요소들이 줄기세포의 기능과 노화에 영향을 미칩니다.
- TGF-β와 같은 순환인자도 줄기세포 기능 조절에 관여하며, 그 수치는 노화 과정에서 변화합니다.
대사 상태의 영향
- 포도당 농도의 변화는 줄기세포의 증식, 분화, 노화에 영향을 미칩니다.
- 높은 포도당 환경은 miR-486의 발현을 증가시켜 세포 노화를 촉진할 수 있습니다.
- SIRT1 억제제인 레스베라트롤은 높은 포도당 환경에서 유발된 노화로부터 줄기세포를 보호할 수 있습니다.
결론
줄기세포의 노화는 신체노화 과정과 밀접한 관계가 있으며, 이를 연구하고 이해하는 과정은 노화 방지(역노화) 및 수명연장에 중요한 역할을 할 것란건 주지의 사실입니다. 줄기세포는 인체내 세포의 지속적인 재생을 지원합니다. 또한 이를 밝히는 것은 저 신대륙을 발견한 탐험가와 같이 미지의 개척지를 개발하는 프론티어라 할 수 있습니다. 다만 현재까지의 줄기세포 노화의 기본 메커니즘에 대한 연구는 작은 결과로 다가와 있지만, 여전히 많은 부분이 발전할 부분이 있다는 것은 우리에게 시사하는 바가 큼니다.
앞서 줄기세포 노화의 주요 요인으로 지목된 DNA 손상 및 돌연변이, 등의 이러한 요인들은 하나의 원인으로 진행되는 것이 아니라 여러 원인에 의한 상호작용을 통하여 줄기세포노화가 진행되며 이는 수명에 중요한 영향을 미침니다. 이 모든것을을 깊이 이해하고 조절하는 것은 노화 연구와 항노화(unageing)에 핵심 주제라 할 것입니다.
향후 연구는 줄기세포 노화에 대한 약물 개발, 노화에 대한 전체 케어시스템 발전등이 주류를 이룰 것으로 보이며, 줄기세포노화의 메커니즘을 더욱 깊이 연구하여 이해하고, 이를 바탕으로 항노화(unageing)약물등으로 노화 과정을 지연시키는 임상적 적용에 점차 결실을 맺을 것으로 기대됩니다. 이러한 연구결과와 적용은 건강한 수명 연장에 중요한 역할을 할 수 있으며, 이는 노화뿐만 아니라 관련된 모든 질병의 예방 및 치료에도 중요한 영향을 미칠 수 있습니다.
슈바르츠의 “불명의 비밀”에는 “사람이 자신의 문제를 해결하기 위해 복용할 수 있는 주사나 알약이 한 가지뿐”이라는 사실을 믿지 않는 것은 우리의 인생을 관통하는 핵심주제이며, 이는 다시말해 실천의식 즉 식이요법, 운동, 영양 및 재생 의학을 포함하는 전체적인 생활 방식의 변화가 자장 중요하며 우리의 수명연장에 가장 기여 한다는것을 명심하여야 할 것입니다.



