INTRO: 초고령 사회를 맞이하는 현대사회의 단상
노화연구는 초고령 사회로 진입하는 현대에 있어서 필수 불가역적인 요소 중 하나입니다. 그리고 그전에 초고령 사회로의 진입은 현대 사회가 직면한 가장 중요한 변화 중 하나입니다. 이는 인구의 상당 부분이 노인이 되는 사회 구조를 의미하며, 다양한 사회적, 경제적, 그리고 건강 관련 문제들을 야기합니다. 이에 따라 생물학적, 사회구조적 연구가 수반되어야 하며 단순 생물학적 연구로 수명이 연장되면 삶이 고통이 되는 아이러니가 만들어 질 수 있음은 명확할 것입니다. 현대의 노화 연구에 있어서 사회적인 현황을 알아보고 최신 연구 내용을 간략하게 알아 볼 것입니다.
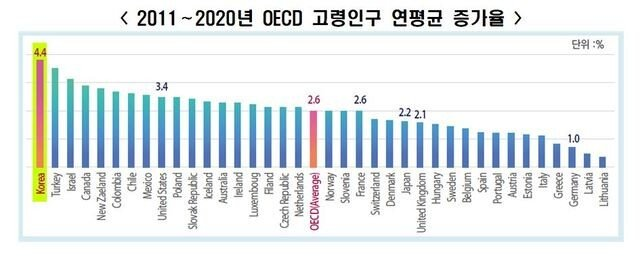
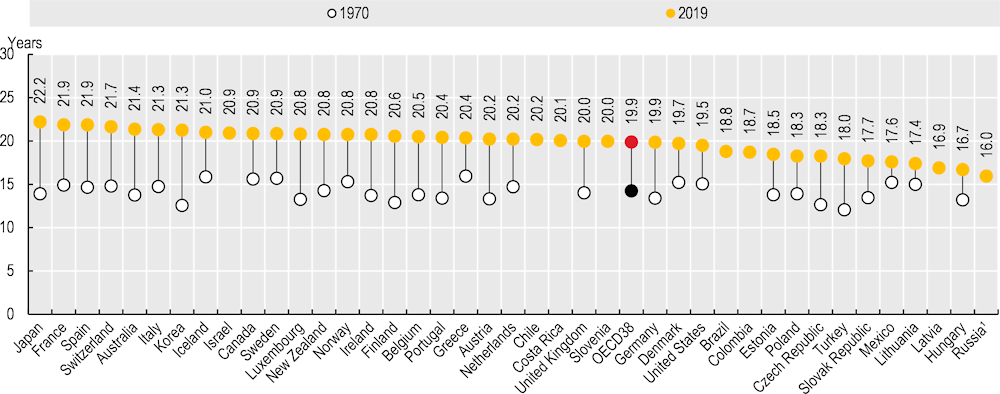
OECD 주요국 초고령사회 도달 소요 연수
노화연구에 있어서 사회적 초고령 사회도달 소요 연수는 생물학적 수명과 사회적 수명의 관계를 알아볼 수 있는 근거가 될 수 있습니다. 보통 고령사회와 초고령사회에 대한 고령인구 비율을 아래와 같습니다. 또한 선진국일수록 고령사회에 접어드는 비율이 높고 특이하게도 한국은 급격하게 높습니다.
- 고령사회 : 고령인구비율 14%이상
- 초고령사회 : 고령인구비율 20%이상
기대수명과 건강수명
기대수명은 사람이 앞으로 살아갈 것으로 예상되는 평균 연수입니다. 건강수명은 개인이 큰 질병이나 장애 없이 건강하게 살 것으로 기대되는 평균 연수를 뜻합니다.
- 기대수명(Life expectancy): 세계보건기구(WHO)에 따르면 2021년 전 세계 기대수명은 73.4세입니다. 선진국의 기대수명은 일반적으로 개발도상국보다 깁니다. 예를 들어, 2021년 미국의 기대 수명은 78.6년인 반면, 시에라리온의 기대 수명은 52.8년이었습니다.
- 건강수명(Healthy lifespan): 건강수명은 일반적으로 기대수명보다 짧습니다. 예를 들어, 미국의 경우 2016년 건강수명은 65.3년이었습니다. 기대 수명과 건강한 수명의 차이는 많은 사람들이 인생의 마지막 몇 년을 만성 질환이나 장애를 안고 보낸다는 사실에 기인합니다.
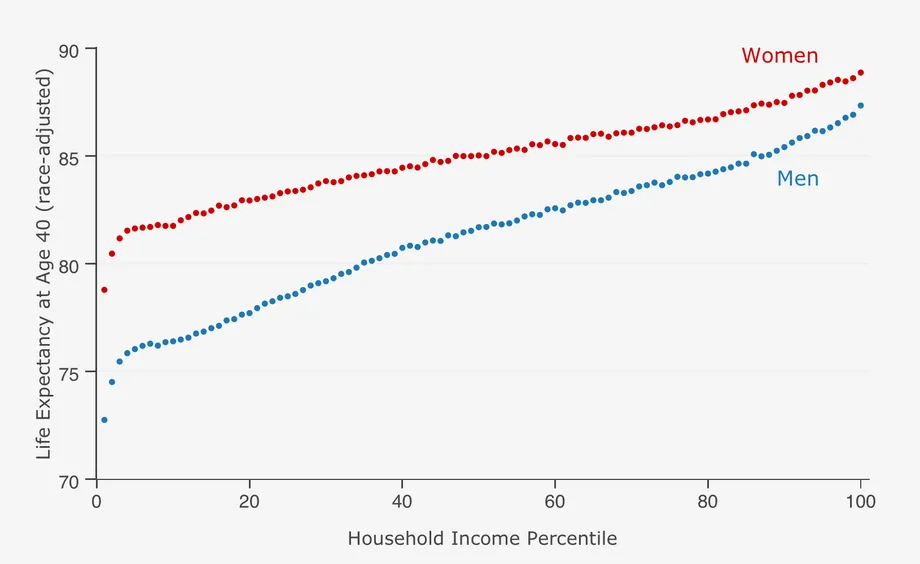
가계 소득이 높을수록 기대수명이 늘어납니다.
“가계 소득이 높을수록 기대수명이 늘어난다”는 현상은 여러 노화연구에서 관찰되는 경향입니다. 이 현상 뒤에는 다양한 요인들이 상호작용하며, 소득 수준이 개인의 건강과 수명에 영향을 미치는 방식을 이해하는 것이 중요합니다.
- 보다 나은 의료 접근성: 높은 소득은 일반적으로 더 나은 의료 서비스에 대한 접근을 의미합니다. 이는 정기적인 건강 검진, 고품질의 치료 서비스, 비용이 많이 드는 의료 절차 또는 약물에 대한 접근 등을 포함할 수 있습니다.
- 건강한 생활 습관: 고소득층은 건강에 좋은 음식, 운동 기회, 스트레스 관리 등 건강한 생활 습관을 유지할 가능성이 더 높습니다. 이는 장기적으로 건강을 유지하고 만성 질환의 위험을 줄이는 데 도움이 됩니다.
- 교육 수준과의 연관성: 소득이 높은 개인은 일반적으로 더 높은 교육 수준을 가지고 있을 가능성이 큽니다. 교육은 건강에 대한 인식을 향상시키고, 건강에 해로운 행동을 피하는 데 도움이 됩니다.
- 환경적 요인: 소득이 높은 가정은 일반적으로 더 나은 주거 환경에 살고 있으며, 오염이 적고, 더 안전하며, 더 나은 공공 서비스와 인프라를 이용할 수 있습니다. 이러한 환경은 건강에 긍정적인 영향을 미칩니다.
- 정신 건강: 높은 소득은 경제적 안정성을 의미하며, 이는 스트레스와 불안감을 줄이는 데 도움이 될 수 있습니다. 정신 건강은 전반적인 건강 상태와 밀접하게 연관되어 있습니다.
- 사회적 지지: 고소득층은 일반적으로 더 나은 사회적 네트워크와 지지 체계를 갖추고 있을 가능성이 높습니다. 이는 스트레스 관리, 건강 문제 발생 시 지원, 및 건강한 생활 방식 유지에 도움이 됩니다.
Life expectancy and healthy life expectancy by income graph
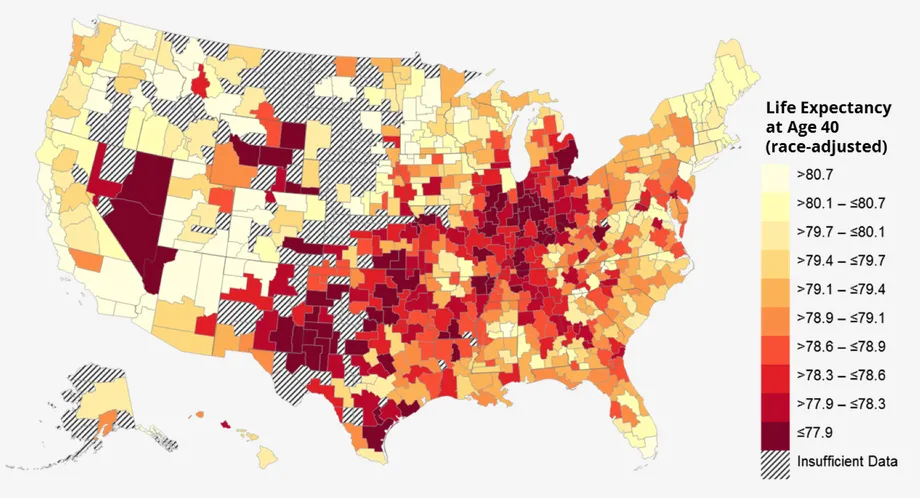
미국 최하위 소득 사분위수의 기대 수명 지리(Health and longevity gaps aren’t inevitable)
65세의 기대수명과 건강수명
기대 수명과 건강 기대 수명의 다른 예로 1970년 ~ 2019년 사이의 각 나라별 기대수명과 건강수명을 조사하였으며, 그 결과 선진국은 대략 50년간 5년정도 늘어나고 그 증가폭 또한 선진국일 수록 높습니다. 이러한 현상이 몇 가지 중요한 사회경제적 및 보건적 요인들에 의해 주도된 것임을 알 수 있습니다.
- 기술 및 의료 발전: 이 기간 동안 선진국에서는 의료 기술과 치료법이 크게 발전했습니다. 이는 만성 질환과 감염성 질환의 관리 향상에 기여했으며, 수술과 치료의 성공률을 높이고 사망률을 낮추는 데 중요한 역할을 했습니다.
- 공중보건 및 예방 캠페인: 선진국에서는 흡연, 알코올 사용, 비만 등의 건강 위험 요소를 줄이기 위한 다양한 공중보건 캠페인이 실시되었습니다. 이러한 캠페인은 만성 질환의 예방과 일반 대중의 건강 인식을 향상시켰습니다.
- 경제적 성장과 소득 수준의 향상: 경제적 성장은 국민의 삶의 질을 향상시켜, 더 나은 건강 관리와 건강한 생활 방식을 가능하게 했습니다. 높은 소득 수준은 더 나은 의료 서비스 접근, 건강한 식습관, 좋은 주거 조건 등을 의미합니다.
- 교육 수준의 향상: 교육 수준이 높아짐에 따라 사람들은 건강에 대해 더 잘 알게 되고, 건강에 해로운 행동을 줄이는 데 도움이 되었습니다. 교육은 건강한 생활 습관을 채택하고 유지하는 데 중요한 역할을 합니다.
- 사회적 안전망의 강화: 선진국에서는 사회 보장 체계와 보건 서비스가 확대되어, 모든 시민이 필요한 의료 서비스를 받을 수 있게 되었습니다. 이는 특히 노인 인구의 건강 관리에 중요한 역할을 했습니다.
Life expectancy and healthy life expectancy at age 65 graph
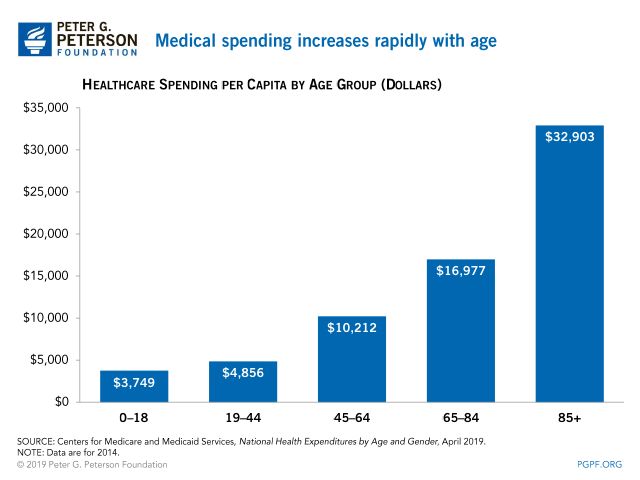
의료비 지출은 연령이 높아짐에 따라 급격히 증가합니다.
연령이 높아짐에 따라 의료비 지출이 급격히 증가하는 현상은 여러 요인에 의해 발생합니다. 이는 고령 인구에서 나타나는 특정 건강상의 필요와 관련된 것으로, 다음과 같은 주요 요인들을 포함합니다.
- 만성 질환의 증가: 나이가 들수록 다양한 만성 질환의 발병 위험이 높아집니다. 고혈압, 당뇨병, 심장 질환, 관절염, 암과 같은 질병들은 지속적인 관리와 치료가 필요하며, 이로 인해 장기적인 의료비 부담이 증가합니다.
- 급성 질환과 사고의 취약성 증가: 고령자는 급성 질환 및 사고로 인한 부상에 더 취약합니다. 낙상, 골절, 급성 감염 등은 종종 고령자에서 병원 입원과 같은 고비용의 의료 서비스를 필요로 합니다.
- 다발성 건강 문제: 고령자는 종종 여러 건강 문제를 동시에 가지고 있으며, 이는 치료 계획을 복잡하게 만들고 추가적인 의료비를 발생시킵니다. 약물 상호작용, 다중 치료 과정 등이 관련됩니다.
- 장기 요양 필요성: 노화와 관련된 기능적 저하로 인해 많은 고령자들이 장기 요양 서비스를 필요로 합니다. 이는 재가 요양, 요양 시설 입소, 가정 내 간병 등 다양한 형태가 있으며, 모두 상당한 비용을 수반합니다.
- 기술적 진보와 비용: 의료 기술의 발전은 새로운 치료법을 제공하지만, 동시에 높은 비용을 수반하는 경우가 많습니다. 고령자들은 이러한 첨단 치료를 필요로 할 수 있으며, 이는 의료비 증가로 이어집니다.
- 예방 및 정기적인 건강 관리: 고령화와 관련된 건강 문제를 예방하거나 관리하기 위해 정기적인 건강 검진, 예방 접종, 건강 상담 등이 필요합니다. 이러한 서비스들은 장기적으로 의료비를 절감할 수 있으나, 단기적으로는 추가 비용이 발생합니다.
Medical Spending Grows With Age
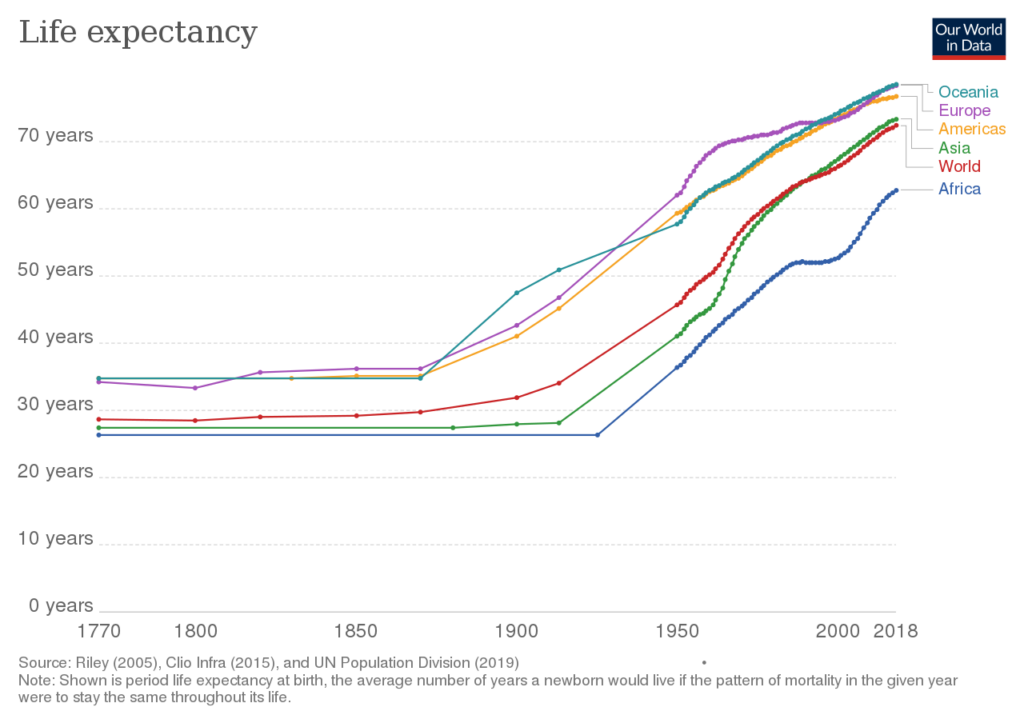
역사적 기대 수명(Historical life expectancy)
시대별로 기대수명이 점점 증가하는 추세이나 이는 영유아 사망율이 높은 비중을 차지하였으며 또한 기근 전염병의 영향이 많았습다. 다만 이러한 사실이 인간의 최대수명이 늘어낮다는 어떤 증거도 될수는 없습니다.
기대수명 증가는 생물학적, 진화적 수명의 증가가 아니라 환경적 요인이 크다 할 수 있습니다.
- 영유아 사망률의 감소: 과거에는 영유아 사망률이 매우 높았습니다. 이는 평균 기대수명을 크게 낮추는 요인이었습니다. 위생 조건의 개선, 백신 접종, 항생제의 발명, 영양 상태의 향상 등으로 20세기 이후 영유아 사망률이 급격히 감소했습니다. 이는 평균 기대수명 증가의 주요 요인 중 하나입니다.
- 전염병 및 기근의 영향 감소: 역사적으로 전염병과 기근은 사망률을 높이는 중요한 요인이었습니다. 하지만 공중 보건의 개선, 의료 시스템의 발달, 농업 기술의 진보 등으로 이러한 위험 요소가 크게 줄었습니다.
- 환경적 요인의 영향: 기대수명의 증가는 주로 환경적 요인에 기인합니다. 이는 건강한 생활 습관, 보다 나은 의료 서비스 접근, 교육 및 소득 수준의 향상 등을 포함합니다.
- 생물학적 또는 진화적 수명의 한계: 현재까지의 과학적 증거는 인간의 생물학적 또는 진화적 최대 수명이 크게 변했다는 것을 직접적으로 입증하지 않습니다. 인간의 최대 수명은 대략 120년 정도로 추정되며, 이는 지난 수 세기 동안 크게 변하지 않았습니다.
- 장수의 복합적 요인: 장수는 유전적 요인, 생활 습관, 사회적 및 환경적 조건 등 다양한 요인의 복합적인 결과입니다. 환경적 개선은 평균 기대수명을 늘렸지만, 최대 수명의 증가에 대해서는 더 많은 연구가 필요합니다.
Historical life expectancy
| 연대 | 출생 시 기대 수명(년) |
| 구석기 시대 | 22~33 |
| 신석기 시대 | 20– 33 |
| 청동기시대 와 철기시대 | 26 |
| 고전 그리스 | 25 – 28 |
| 고대 로마 | 20~33 |
| 중국 1세기. 서기 – 1749년 | 35 |
| 중세 초기 (유럽, 5세기 – 10세기) | 30~35 |
| 근대 초기 영국 (16~18세기) | 33~40 |
| 18세기 영국 | 25~40 |
| 18세기 미국 식민지 | 28 |
| 19세기 초 영국 | 40 |
| 19세기 세계 평균 | 28.5~32 |
| 1900년 세계 평균 | 31~32 |
| 1950년 세계 평균 | 45.7~48 |
| 2019~2020년 세계 평균 | 72.6~73.2 |
Historical life expectancy graph
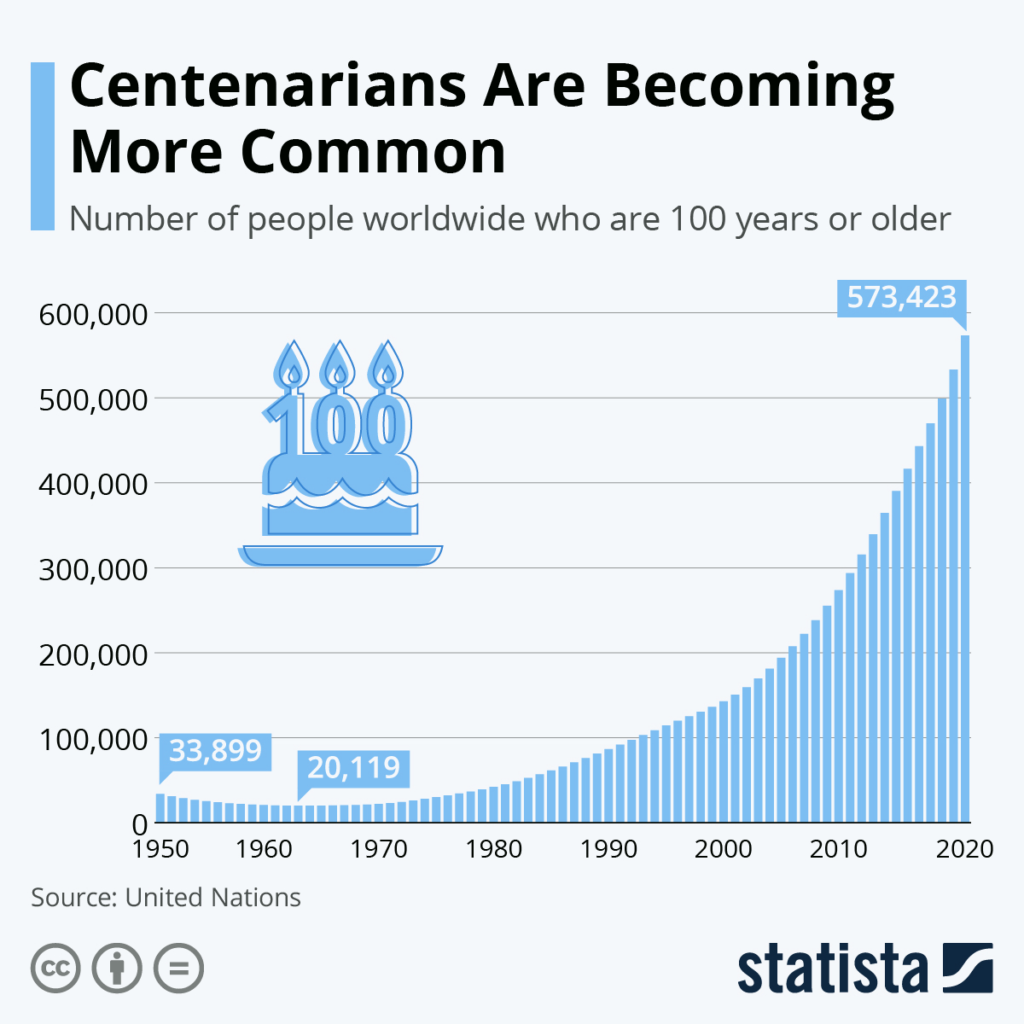
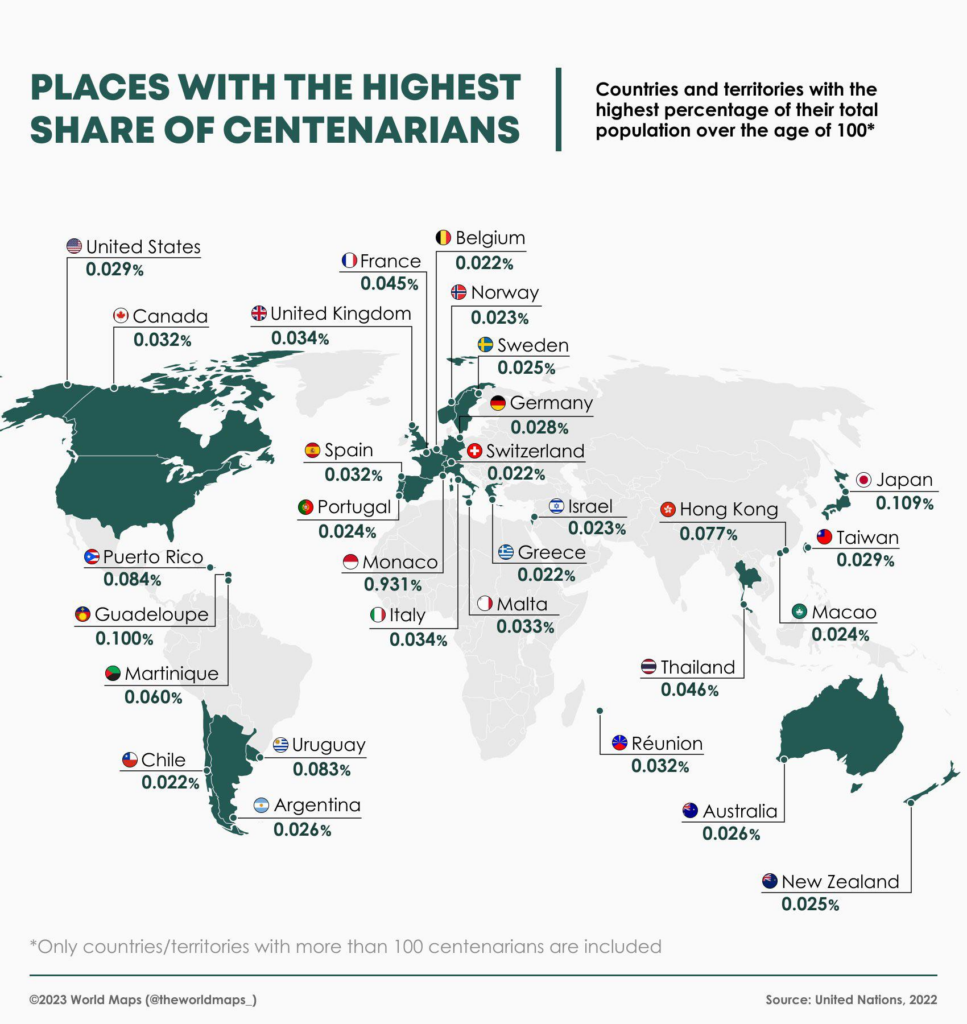
100세 이상 노인이 점점 더 일반화되고 있습니다
Centenarians Are Becoming More Common
100세 이상 새로운 장소 80곳
Where 100 is the New 80
노화연구: 노화를 막을수 있는가
노화(Aging)
과거의 노화억제 또는 극복 사례
과거의 노화 억제 또는 극복을 시도한 사례들은 인류 역사에서 장수와 영원한 청춘에 대한 갈망을 반영합니다. 이러한 사례들은 대부분 전설, 신화, 또는 역사적인 이야기에 뿌리를 두고 있으며, 실제적인 과학적 근거는 단1도 없으며, 당시의 신념과 상상력을 반영하는 경우가 많습니다.
- 진시황: 중국의 첫 황제인 진시황은 불로불사의 약을 찾는 데 많은 노력을 기울였다고 알려져 있습니다. 그는 불사의 약을 만들 수 있다고 주장하는 약사들과 무당들을 후원했으며, 전설에 따르면 이런 노력은 결국 그의 건강을 해치고 생명을 단축시켰다고 합니다.
- 폰세 데 레온: 스페인의 정복자 폰세 데 레온은 종종 ‘젊음의 샘’을 찾아 북아메리카를 탐험한 인물로 알려져 있습니다. 그러나 이는 후세의 이야기일 뿐이며, 실제 역사적 기록에는 그가 젊음의 샘을 찾기 위해 여행을 떠났다는 증거는 없습니다.
- 젊음의 샘: ‘젊음의 샘’은 전설 속에 등장하는 신비한 물이며, 이를 마시면 영원한 젊음을 유지할 수 있다고 여겨졌습니다. 이는 여러 문화와 신화에서 찾아볼 수 있는 모티브로, 인간이 노화와 죽음을 극복하려는 오랜 열망을 상징합니다.
- 엘리자베스 바토리: 16세기 헝가리의 귀족 여성인 엘리자베스 바토리는 젊음을 유지하기 위해 처녀들의 피를 목욕물로 사용했다고 전해집니다. 그녀의 이야기는 주로 전설과 과장에 기반하고 있으며, 역사적 사실과는 다를 수 있습니다.
이러한 사례들은 실제적인 노화 억제 방법이라기보다는 인간의 불멸과 영원한 젊음에 대한 꿈을 반영한 것으로, 현대 과학에서 노화를 연구하는 방식과는 크게 다릅니다. 오늘날의 노화 연구는 생물학, 유전학, 의학 등의 실증적인 접근을 통해 이루어지고 있으며, 과거의 이야기들은 주로 문화적, 역사적 관점에서 탐구됩니다.
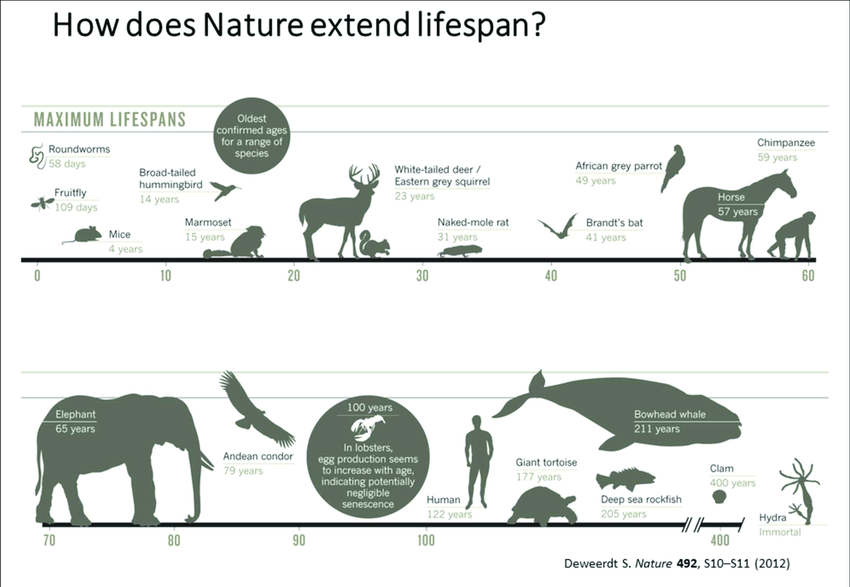
생물별 수명
생물 종에 따라 수명이 크게 다르며, 일부 종은 특히 높은 수명을 가지고 있습니다. 여기서 언급된 북극고래, 뽈락, 그리고 히드라는 각각 매우 긴 수명을 가진 것으로 알려져 있습니다.
- 북극고래 (Bowhead Whale): 북극고래는 현재 알려진 고래 종 중에서 가장 긴 수명을 가진 것으로 추정됩니다. 일부 개체는 200년 이상 살 수 있다고 알려져 있습니다. 이들의 나이는 몸에 남은 고래잡이 시대의 창이나 다른 물체들, 그리고 북극고래의 눈에 존재하는 특정한 변화를 통해 추정할 수 있습니다.
- 뽈락 (Rougheye Rockfish): 뽈락은 북태평양에 서식하는 어류로, 이 물고기의 일부 개체는 200년 이상 살 수 있다고 알려져 있습니다. 이들의 나이는 주로 귀석(otoliths, 물고기의 귀에 있는 작은 돌)의 성장 층을 통해 추정됩니다.
- 히드라 (Hydra): 히드라는 담수 환경에서 살고 있는 작은 무척추동물로, 이론적으로는 무한한 수명을 가질 수 있다고 생각됩니다. 히드라는 매우 느린 또는 거의 없는 세포 노화 과정을 가지며, 끊임없이 자신의 세포를 재생하는 능력을 가지고 있습니다. 이러한 특징 때문에, 히드라는 노화 연구에서 중요한 연구 대상입니다.
이러한 생물들의 수명은 그들이 살고 있는 환경, 유전적 요인, 생리학적 특성 등 다양한 요인에 의해 결정됩니다. 특히 히드라의 경우, 그들의 놀라운 재생 능력과 노화 지연 현상은 생물학적 노화 과정을 이해하는 데 중요한 통찰을 제공합니다.
자연선택의 그림자
“자연선택의 그림자”는 생물 진화의 핵심 메커니즘인 자연선택을 설명하는데 사용되는 개념입니다. 자연선택은 찰스 다윈이 제안한 진화 이론의 주요 부분으로, 생물종이 환경에 적응해 가는 과정을 이해하는 데 중요한 역할을 합니다. 여기에는 몇 가지 주요 단계가 있습니다.
- 변이의 발생: 모든 생물종 내의 개체들은 유전적으로 다양합니다. 이러한 변이는 돌연변이, 유전자 재조합, 그리고 다른 유전적 메커니즘을 통해 발생합니다. 이 변이들은 개체들이 서로 다른 특성을 가지게 만들며, 이는 모양, 크기, 행동, 내구성 등 다양한 형태로 나타납니다.
- 환경의 변화와 적응: 환경 조건이 변하면, 특정 유전적 변이가 다른 변이보다 더 유리할 수 있습니다. 예를 들어, 특정 기후 조건에서는 어떤 색깔이나 털의 길이가 생존에 더 유리할 수 있습니다. 이러한 유리한 변이는 개체가 해당 환경에서 살아남고 번식하는 데 도움을 줍니다.
- 생존과 번식: 유리한 유전적 변이를 가진 개체들은 일반적으로 더 많이 생존하고 번식합니다. 이는 자연선택의 기본 원리로, 이러한 개체들은 자신의 유전자를 후손에게 더 많이 전달할 기회를 가집니다.
- 유전적 특성의 누적: 시간이 지나면서, 유리한 유전적 변이는 해당 종 내에서 더 흔하게 됩니다. 이는 세대를 거치며 발생하는 점진적인 변화로, 종이 환경에 더 잘 적응하게 만들며, 장기적으로는 종의 진화로 이어질 수 있습니다.
자연선택은 진화 과정에서 중요한 동력으로 작용하며, 생물종이 변화하는 환경에 적응하고, 새로운 환경에 진출하며, 심지어 새로운 종으로 분화하는 데 기여합니다. 이 과정은 매우 천천히 진행되며, 수많은 세대에 걸쳐 발생합니다. 자연선택은 생물학, 생태학, 유전학 등 다양한 과학 분야에서 중요한 연구 주제입니다.
노화의 진화이론
노화의 진화이론은 노화가 자연선택의 결과로 발생한다는 이론입니다. 자연선택은 환경에 적합한 형질을 가진 개체가 더 오래 생존하고 더 많은 자손을 낳는 현상입니다.
- 돌연변이 유전자의 변이를 말합니다. 돌연변이는 자연적으로 발생하거나, 방사선이나 화학물질과 같은 환경적 요인에 의해 발생할 수 있습니다. 돌연변이는 유전적 다양성을 증가시키는 데 중요한 역할을 합니다.
- 일회용품 사용 후 버려지는 제품을 말합니다. 노화의 진화이론에 따르면, 노화는 일회용품과 같은 개념입니다. 개체는 성숙기에 도달하면 더 이상 번식에 기여할 수 없습니다. 따라서 자연선택은 노화를 통해 개체의 에너지와 자원을 다음 세대에 전달할 수 있게 합니다.
- 두얼굴 노화의 양면성을 말합니다. 노화는 신체적, 정신적 기능의 저하와 질병의 위험 증가를 동반합니다. 그러나 노화는 또한 지혜와 경험의 축적을 의미하기도 합니다.
노화속도의 결정 요인
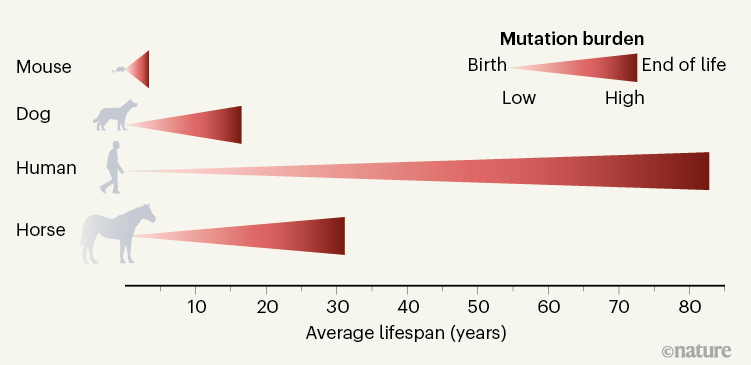
“돌연변이 시계”라는 개념은 생물 종에 따라 돌연변이가 발생하는 속도가 다르다는 것을 나타냅니다. 이는 각 생물의 세포 분열과 DNA 복제 과정에서 발생하는 돌연변이의 빈도와 관련이 있습니다. 여기서 중요한 발견은 수명이 긴 동물들이 수명이 짧은 동물들에 비해 느리게 돌연변이를 획득한다는 것입니다. 이러한 현상은 다음과 같은 방식으로 이해될 수 있습니다.
- 세포 분열과 돌연변이: 돌연변이는 세포가 분열하고 DNA가 복제될 때 발생합니다. 이 과정에서 DNA 복제 오류, 환경적 요인, 방사선 노출 등으로 인해 돌연변이가 생길 수 있습니다.
- 수명과 돌연변이 빈도: 수명이 긴 동물들, 특히 대형 포유류 같은 경우, 세포 분열이 더 천천히 일어나고, DNA 복제 과정에서 발생하는 돌연변이의 빈도도 더 낮습니다. 이는 수명이 긴 종에서 암과 같은 돌연변이 관련 질병의 위험이 상대적으로 낮게 유지되는 한 원인이 될 수 있습니다.
- 돌연변이 수리 메커니즘: 또한, 수명이 긴 동물들은 DNA 손상을 보다 효과적으로 수리할 수 있는 메커니즘을 가질 가능성이 높습니다. 이는 세포의 돌연변이 부담을 줄여줄 수 있으며, 장수와 관련이 있을 수 있습니다.
- 암 발생과 관련성: 암은 돌연변이의 축적에 의해 발생합니다. 수명이 긴 종에서 돌연변이가 느리게 축적된다는 것은 이들이 암 발생 위험이 상대적으로 낮음을 의미할 수 있습니다. 그러나 이는 암이 전혀 발생하지 않는다는 것을 의미하지는 않습니다.
- 종의 진화적 적응: 수명이 긴 종은 진화적으로 돌연변이를 효율적으로 관리하고, 장기적인 생존을 위한 다른 생리학적 적응을 발달시켰을 가능성이 있습니다.
이러한 메커니즘은 생물 종의 수명과 돌연변이 발생 속도 간의 관계를 이해하는 데 중요한 역할을 합니다. 돌연변이 시계의 속도는 종마다 다르며, 이는 각 종의 생존 전략과 진화 과정에 영향을 미칩니다.
생물의 DNA 손상복구 능력 증대
DNA 손상 복구 능력의 증대와 유전체 안정성(genome stability) 유지는 생물학에서 매우 중요한 연구 주제입니다. 특히, DNA 이중 가닥 파열(Double-strand Break, DSB)의 효율적인 복구는 세포의 유전체 안정성 유지에 필수적입니다. 여기에는 몇 가지 핵심 개념과 메커니즘이 포함됩니다.
- DNA 손상의 원인: DNA는 다양한 내부 및 외부 요인에 의해 손상될 수 있습니다. 여기에는 자외선 노출, 화학물질, 방사선, 자유 라디칼, 그리고 세포의 정상적인 대사 과정에서 발생하는 스트레스 등이 포함됩니다.
- DNA 이중 가닥 파열 (DSB): DSB는 DNA의 두 가닥이 모두 파열되는 것을 말하며, 이는 세포에 매우 심각한 손상을 입힐 수 있습니다. DSB는 유전 정보의 손실이나 잘못된 재결합으로 이어질 수 있어, 암과 같은 질병의 원인이 될 수 있습니다.
- DSB 복구 메커니즘: 세포는 DSB를 복구하기 위한 두 가지 주요 메커니즘을 가지고 있습니다. 하나는 비동종 엔드 결합(Non-homologous End Joining, NHEJ)이고, 다른 하나는 동종 재조합(Homologous Recombination, HR)입니다. NHEJ은 비교적 빠르고 간단하지만, 때때로 잘못된 복구를 일으킬 수 있습니다. HR은 더 정확하지만, 더 복잡하고 시간이 더 많이 소요됩니다.
- 유전체 안정성의 중요성: 유전체 안정성은 세포의 정상적인 기능과 생존에 필수적입니다. DNA 손상 복구 메커니즘의 효율성은 유전체 안정성을 유지하고 세포의 노화, 사멸, 암화 등을 방지하는 데 중요한 역할을 합니다.
- DNA 손상 복구 능력의 증대: 연구자들은 약물, 유전자 치료, 생명공학 기술을 사용하여 DNA 손상 복구 능력을 향상시키려고 합니다. 이는 특히 암 치료, 노화 방지, 유전 질환 치료 등의 분야에서 중요한 응용 가능성을 가지고 있습니다.
DNA 손상 복구 능력의 증대와 유전체 안정성 유지는 현대 노화연구에 있어서 생물학 및 의학 연구에서 중요한 목표 중 하나이며, 이 분야의 연구는 계속해서 발전하고 있습니다.
인간수명의 한계
수명한계가 있다는 주장
- 이 주장의 지지자들은 인간의 수명이 특정 생물학적, 유전적 한계에 의해 제한된다고 믿습니다.
- 연구들은 인간의 최대 수명이 약 120년 정도로 제한되어 있다는 증거를 제시합니다.
- 이들은 세포의 노화, 텔로미어의 단축, 세포 분열의 한계(하이플릭 한계), 그리고 대사 과정에서 발생하는 누적적 손상 등을 주된 이유로 꼽습니다.
- 이러한 생물학적 제한은 특정 질병의 증가, 신체 기능의 저하 등과 관련이 있습니다.
Evidence for a limit to human lifespan
샤오 동, 브랜든 밀홀랜드, 그리고 얀 비그가 진행한 연구는 인간 수명의 한계에 대한 중요한 증거를 제공합니다. 이 연구는 “Nature” 저널에 2016년에 발표되었으며, 전 세계 인구통계학적 데이터를 분석하여 인간 수명에 관한 중요한 결론을 도출했습니다.
연구의 주요 발견은 다음과 같습니다:
- 기대 수명의 증가: 19세기 이후로 기술과 의학의 발전 덕분에 인간의 평균 기대 수명이 크게 증가했습니다. 노령 인구의 사망률 감소와 최대 사망 연령의 증가가 이를 뒷받침합니다.
- 생존율의 변화: 그러나 연구는 100세 이상의 연령대에서 생존율의 향상이 감소하는 경향을 보였습니다. 이는 고령에 도달할수록 생존 가능성이 줄어든다는 것을 의미합니다.
- 최고령자의 사망 연령 정체: 또한, 세계 최고령자의 사망 연령이 1990년대 이후 크게 증가하지 않았다는 것도 발견했습니다. 이는 최대 수명이 일정 수준에 도달한 후 더 이상 늘어나지 않고 있음을 시사합니다.
- 수명의 자연적 제약: 이러한 결과들은 인간의 최대 수명이 자연적인 제약을 받으며, 이는 어느 정도 고정되어 있을 수 있다는 강력한 주장을 제시합니다.
이 연구는 인간 수명에 대한 생물학적 한계가 존재할 수 있음을 시사하며, 이러한 한계가 자연선택과 유전적 요인에 의해 결정될 수 있다는 견해를 뒷받침합니다. 이러한 연구는 노화와 장수에 관한 과학적 이해를 넓히는 데 중요한 기여를 하며, 인간 수명의 한계에 대한 더 깊은 연구와 논의를 촉진합니다.
수명한계가 없다는 주장
- 이 주장의 지지자들은 의학, 기술, 생활 방식의 개선을 통해 인간의 수명을 늘릴 수 있다고 믿습니다.
- 최근의 연구에서는 건강 관리와 의학적 진보로 인해 인간의 최대 수명이 계속해서 늘어날 수 있다고 제안합니다.
- 이들은 유전자 편집, 줄기세포 치료, 노화 방지 약물 등의 혁신적인 치료 방법이 노화 과정을 늦추거나 되돌릴 수 있다고 주장합니다.
- 일부 연구에서는 특정 개인이나 집단에서 120년을 초과하는 수명이 관찰되었다는 보고도 있습니다.
Questionable evidence for a limit to human lifespan
아담 레나르트와 제임스 W. 보펠이 진행한 연구는 인간 수명의 한계에 대해 의심스러운 증거를 제시합니다. 이 연구는 “Nature” 저널에 2017년에 게재되었으며, X. Dong, B. Milholland 및 J. Vijg가 2016년에 발표한 인간 수명 한계에 관한 연구에 대한 반박입니다.
이 연구의 주요 내용은 다음과 같습니다:
- 이전 연구의 결과에 대한 의문 제기: 레나르트와 보펠은 Dong 등이 수행한 연구의 결과와 해석에 의문을 제기합니다. Dong 등의 연구는 인간의 최대 수명이 고정되어 있으며 자연적인 제약을 받는다는 결론을 내렸으나, 레나르트와 보펠은 이러한 결론이 충분한 증거에 기반하지 않았다고 주장합니다.
- 통계적 분석의 문제점: 이들은 Dong 등의 연구에서 사용된 통계적 방법론이 수명 한계에 대한 결론을 내리기에 적절하지 않았다고 지적합니다. 특히, 최고령자의 사망 연령이 정체되었다는 주장에 대한 데이터 해석에 문제가 있다고 강조합니다.
- 수명 한계 논쟁의 지속: 레나르트와 보펠의 연구는 인간 수명의 한계에 대한 논쟁이 여전히 해결되지 않았음을 보여줍니다. 이들은 더 많은 데이터와 더 정교한 분석이 필요하다고 주장하며, 인간 수명이 계속해서 늘어날 수 있다는 가능성을 열어둡니다.
이 연구는 인간 수명에 관한 과학적 이해가 여전히 발전 중임을 보여주며, 이 주제에 대한 추가적인 연구와 토론을 촉진합니다. 인간 수명의 한계에 대한 이러한 논의는 노화, 장수, 그리고 관련된 생물학적 및 사회적 요인들을 이해하는 데 중요한 기여를 합니다.
Maximum lifespans graph
노화연구: 노화지연 약물 연구
Aspirin
- 특징: 비스테로이드 항염증제(NSAID)로 분류되는 약물입니다.
- 노화와의 관계: 여러 연구에서 약피린이 염증을 줄이고, 혈전을 방지하는 효과가 있음이 확인되어, 심혈관 질환 예방과 관련하여 노화 지연 효과에 주목받고 있습니다.
- 기타: 장기적이고 정기적인 약피린 사용은 위 출혈과 같은 부작용이 있을 수 있습니다.
Rapamycin
- 특징: 랩사마이신은 항균제로 발견되었으며, 이후 면역억제제로 널리 사용되고 있습니다.
- 노화와의 관계: mTOR(mechanistic target of rapamycin) 경로를 억제하여 단백질 합성, 세포 분열, 및 대사에 영향을 미치며, 이는 세포의 생존과 성장에 중요합니다. 랩사마이신은 이 경로를 조절하여 노화 및 관련 질환의 리스크를 감소시키는 것으로 연구되고 있습니다.
Resveratrol
- 특징: 레스베라트롤은 와인, 포도, 블루베리에서 찾을 수 있는 폴리페놀 화합물입니다.
- 노화와의 관계: Sirtuin 활성화와 관련된 항산화 및 항염증 효과로 노화 지연과 연결되곤 합니다. 그러나 인간에서의 노화 지연 효과에 대한 확실한 증거는 제한적입니다.
- 기타: 다양한 세포 및 동물 모델에서의 긍정적인 효과에 대한 연구가 있지만, 이를 사람에게 직접적으로 확장하는 것은 복잡합니다.
Metformin
- 특징: 메트포민은 2형 당뇨병의 치료에 사용되는 약물입니다.
- 노화와의 관계: 메트포민은 AMPK(AMP-활성화된 단백질 키나제)를 활성화하여 세포의 에너지 상태를 조절하며, 이는 대사 및 노화 과정과 관련이 있습니다. 메트포민이 노화를 지연시키고, 노화와 관련된 질환의 위험을 감소시키는 것으로 여겨지고 있습니다.
- 기타: 현재 이 약물은 당뇨병 치료 외에도 노화연구에서 큰 주목을 받고 있습니다.//
영국의 생명과학 10년 비전(Life Sciences Vision)
영국 정부가 제시한 영국의 생명과학 비전은 향후 10년 동안 의료 및 연구 발전을 목표로 하는 몇 가지 주요 임무에 중점을 두고 있습니다. 이러한 임무에는 다음이 포함됩니다.
- 신경변성 및 치매의 중개 능력 향상: 이 임무는 연구 결과를 치매를 포함한 신경퇴행성 질환에 대한 실제 치료법으로 전환하는 데 중점을 둡니다.
- 조기 진단 및 치료 가능: 여기에는 질병을 초기 단계에서 진단하고 치료하기 위한 암 백신과 같은 면역 치료법의 개발이 포함됩니다.
- 신규 백신 발견, 개발 및 제조 분야에서 영국의 입지 유지: 이 임무는 백신 혁신 및 생산 분야에서 영국의 역량을 유지하고 향상시키는 것을 목표로 합니다.
- 심혈관 질환의 치료 및 예방: 이는 비만과 같은 심혈관 질환의 주요 위험 요소를 해결하는 것을 포함합니다.
- 호흡기 질환으로 인한 사망률 및 질병률 감소: 이 임무는 영국과 전 세계적으로 호흡기 질환으로 인한 사망률과 건강 합병증을 줄이는 것을 목표로 합니다.
- 노화의 기본 생물학 다루기: 이는 노화의 근본적인 생물학적 과정을 이해하는 데 중점을 둡니다.
- 정신 건강 상태에 대한 이해 증대: 여기에는 질병을 재정의하고 정신 건강 상태를 더 잘 해결하기 위한 도구 개발이 포함됩니다[48†출처].
이러한 임무는 과학 연구, 임상 개발 및 의료 혁신 분야에서 영국의 강점을 활용하여 일부 주요 의료 문제를 해결하기 위한 포괄적인 접근 방식을 반영합니다.
젊은생쥐 늙은생쥐 실험
이 연구는 쥐에서 이종만성 파라바이오시스(HPB)가 기능적 회춘 효과를 가져온다는 것을 밝힙니다. 연구에서는 3개월 동안 HPB를 수행한 후, 2개월 동안 쥐를 분리했습니다. 분리된 늙은 쥐들은 생리적으로 개선된 상태를 보였고, 일반 쥐보다 더 긴 수명을 보였습니다. HPB는 혈액과 간의 후생유전학적 연령을 줄였으며, 이 회춘 효과는 분리 후에도 지속되었습니다. 연구 결과는 HPB가 수명과 건강 기간을 연장시키는 지속적인 후성유전학적 및 전사체 리모델링을 초래한다는 것을 보여줍니다.
이종만성 파라바이오시스(Heterochronic Parabiosis, HPB)는 두 마리의 쥐를 수술적으로 연결하여 그들의 순환계를 공유하게 만드는 실험적 절차입니다. 이 방법은 다른 연령의 쥐를 서로 연결하는 데 사용됩니다—예를 들어, 젊은 쥐와 늙은 쥐를 함께 연결합니다. 이런 연결을 통해 연구자들은 노화 과정에 대한 더 나은 이해와 젊음의 요소가 노화된 조직에 어떤 영향을 미치는지 관찰할 수 있습니다. HPB는 노화 연구에서 중요한 도구로 사용되며, 특히 노화의 생물학적 과정과 장수에 관한 연구에 활용됩니다.
노화로 인한 혈액인자의 변화
First Results of a Clinical Trial to “Cure Aging” Using Young Blood Just Came in
젊은 혈액을 사용하여 노화를 치료하는 임상 시험의 첫 번째 결과가 발표되었습니다. 이 연구는 젊은 사람들의 혈액이 노화 관련 질병, 특히 알츠하이머병 치료에 도움이 될 수 있다는 가설을 탐구합니다. 이러한 접근 방식은 이전의 동물 연구에서 관찰된 젊은 혈액의 잠재적인 회춘 효과에 기반을 두고 있으며, 인간에서의 효과와 안전성을 확인하기 위한 첫 단계입니다. 그러나 이러한 연구는 여전히 초기 단계이며, 그 결과와 의학적 잠재력을 평가하기 위해서는 추가 연구와 검증이 필요합니다.
노화연구의 중심: 노화지연
노화지연에 가장 효과적인 것은 행동입니다. 즉 적게먹고 움직이는 것입니다. 가장 일반적이며 널리 알려진 사실이지만 이는 “공부를 열심히 하면 성적이 오른다”라는 일반론적인 것으로 누구나 실천하기 쉽지 않으며, 또한 모든 사람이 동일하게 할 수 없습니다. 이에 노화연구에 있어서 소식과 운동을 할 때 우리 몸속에서 분비되는 여러 호르몬 분비를 기초로 밝혀진 물질이 많이 있습니다.
노화연구로 밝혀진 소식과 관련된 약물
칼로리 제한 (CR)과 Rapamycin
Colorie Restriction(CR) → Insulin/IGF signaling → [mTOR ← Rapamycin] → Autophagy
CR은 섭취 열량을 줄이는 것을 의미하며, 이는 인슐린/IGF 신호 전달을 감소시켜 mTOR 활성을 감소시킵니다. mTOR는 자가포식(autophagy)를 억제하는 역할을 합니다. Rapamycin은 mTOR의 활성을 직접적으로 억제하는 약물로, 자가포식을 활성화시키는 효과가 있습니다.
Metformin
Colorie Restriction(CR) → AMP/ATP ratio → [AMPK ← Metformin] → Autophagy
CR은 AMP/ATP 비율을 증가시키며, 이는 AMPK(AMP-activated protein kinase)를 활성화시킵니다. AMPK는 자가포식을 활성화시키는 역할을 합니다. Metformin은 AMPK의 활성을 직접적으로 증가시키는 약물로, 자가포식을 활성화시키는 효과가 있습니다.
Spermidine
[EP300 ← Spermidine] → Autophagy
Spermidine은 폴리아민의 일종으로서 자가포식을 활성화시키는 효과가 있습니다. Spermidine은 EP300의 활성을 억제하며, EP300은 자가포식을 억제하는 역할을 하므로, EP300의 활성이 억제되면 자가포식이 활성화됩니다.
CR, Rapamycin, Metformin, Spermidine은 모두 autophagy를 활성화시키는 효과가 있습니다. Autophagy는 세포 내 손상된 단백질과 오르가넬을 제거하는 과정으로, 노화와 관련된 질병의 예방과 치료에 효과적일 수 있다고 알려져 있습니다.
운동과 관련된 약물
대표적인 운동관련 약물 : GPLD1
GPLD1은 골격근에서 분비되는 단백질입니다. 운동을 하면 GPLD1의 생성이 증가합니다. GPLD1은 다음과 같은 효과를 가지고 있습니다.
- 신경재생 증가 GPLD1은 신경세포의 성장과 분화를 촉진하는 효과가 있습니다. 또한, 신경세포의 손상을 복구하는 효과가 있습니다. 따라서, GPLD1은 뇌졸중, 알츠하이머병과 같은 신경질환의 치료에 도움이 될 수 있습니다.
- 인지기능 개선 GPLD1은 인지기능을 개선하는 효과가 있습니다. 기억력, 학습능력, 주의력과 같은 인지기능을 향상시키는 것으로 알려져 있습니다. 따라서, GPLD1은 치매 예방 및 치료에 도움이 될 수 있습니다. GPLD1의 신경재생 및 인지기능 개선 효과에 대한 연구는 아직 초기 단계에 있습니다. 그러나, 동물 실험에서 GPLD1이 이러한 효과를 가지고 있다는 것이 밝혀졌습니다. 또한, 인간을 대상으로 한 임상 시험에서도 GPLD1의 신경재생 및 인지기능 개선 효과가 확인되었습니다. GPLD1은 신경질환과 인지기능 저하의 치료에 새로운 가능성을 제시하는 물질입니다. 앞으로 GPLD1의 효과와 안전성에 대한 연구가 더 진행될 것으로 기대됩니다. GPLD1의 신경재생 및 인지기능 개선 효과를 뒷받침하는 연구 결과는 다음과 같습니다.
- 쥐를 대상으로 한 연구에서 GPLD1이 뇌졸중으로 인한 신경세포 손상을 줄이고, 신경세포의 성장과 분화를 촉진하는 것으로 나타났습니다.
- 알츠하이머병에 걸린 쥐를 대상으로 한 연구에서 GPLD1이 뇌의 베타 아밀로이드 플라크를 제거하고, 인지기능을 개선하는 것으로 나타났습니다.
- 치매 환자를 대상으로 한 임상 시험에서 GPLD1이 인지기능을 개선하는 것으로 나타났습니다.
근육 관련 약물
- 12, 13-diHOME: 근육 성장과 회복에 관여하는 물질입니다. 운동을 하면 12, 13-diHOME의 생성이 증가합니다. 12, 13-diHOME은 근육 세포의 성장과 분화를 촉진하고, 근육 손상을 복구하는 데 도움이 됩니다.
- Adiponectin: 지방세포에서 분비되는 호르몬입니다. 근육 성장과 회복에 관여하는 물질입니다. 운동을 하면 adiponectin의 생성이 증가합니다. adiponectin은 근육 세포의 성장과 분화를 촉진하고, 근육 손상을 복구하는 데 도움이 됩니다.
- Apelin: 인슐린 분비를 촉진하는 물질입니다. 운동을 하면 apelin의 생성이 증가합니다. apelin은 근육의 포도당 흡수를 증가시키고, 근육 성장을 촉진하는 데 도움이 됩니다.
- Fetuin-A: 골격근의 성장과 유지에 관여하는 단백질입니다. 운동을 하면 fetuin-A의 생성이 증가합니다. fetuin-A는 근육 세포의 성장과 분화를 촉진하고, 근육 손상을 복구하는 데 도움이 됩니다.
- Follistatin: 근육 성장을 촉진하는 단백질입니다. 운동을 하면 follistatin의 생성이 증가합니다. follistatin은 근육 세포의 성장과 분화를 촉진하고, 근육 손상을 복구하는 데 도움이 됩니다.
- HSP72: 열 충격 단백질의 일종으로서, 세포 손상을 예방하고 회복하는 데 도움이 됩니다. 운동을 하면 HSP72의 생성이 증가합니다. HSP72는 근육의 손상을 예방하고 회복하는 데 도움이 됩니다.
- IL-6, 7, 15: 염증성 사이토카인으로서, 근육 성장과 회복에 관여하는 물질입니다. 운동을 하면 IL-6, 7, 15의 생성이 증가합니다. IL-6, 7, 15는 근육 세포의 성장과 분화를 촉진하고, 근육 손상을 복구하는 데 도움이 됩니다.
- Myostatin: 근육 성장을 억제하는 단백질입니다. 운동을 하면 myostatin의 활성이 감소합니다. myostatin의 활성이 감소하면 근육 성장이 촉진됩니다.
- SDC4: 세포 사이의 연결을 형성하는 단백질입니다. 운동을 하면 SDC4의 생성이 증가합니다. SDC4의 생성이 증가하면 근육의 성장과 회복이 촉진됩니다.
- SPARC: 세포의 이동을 억제하는 단백질입니다. 운동을 하면 SPARC의 활성이 감소합니다. SPARC의 활성이 감소하면 근육의 성장과 회복이 촉진됩니다.
췌장 관련 약물
- BAIBA: 췌장에서 분비되는 단백질입니다. 인슐린 분비를 촉진하고, 혈당 수치를 조절하는 데 도움이 됩니다. 운동을 하면 BAIBA의 생성이 증가합니다. BAIBA는 췌장의 베타 세포 기능을 보호하고, 노화로 인한 당뇨병의 위험을 감소시키는 데 도움이 됩니다.
- Fetuin-A: 골격근의 성장과 유지에 관여하는 단백질입니다. 췌장에서도 Fetuin-A가 분비됩니다. 운동을 하면 Fetuin-A의 생성이 증가합니다. Fetuin-A는 췌장의 베타 세포 기능을 보호하고, 노화로 인한 당뇨병의 위험을 감소시키는 데 도움이 됩니다.
- Follistatin: 근육 성장을 촉진하는 단백질입니다. 췌장에서도 Follistatin이 분비됩니다. 운동을 하면 Follistatin의 생성이 증가합니다. Follistatin은 췌장의 베타 세포 기능을 보호하고, 노화로 인한 당뇨병의 위험을 감소시키는 데 도움이 됩니다.
지방관련 약물
- 12, 13-diHOME: 지방 분해를 촉진하는 물질입니다. 운동을 하면 12, 13-diHOME의 생성이 증가합니다. 12, 13-diHOME은 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- Adiponectin: 지방세포에서 분비되는 호르몬입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 adiponectin의 생성이 증가합니다. adiponectin은 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- Angiopoietin like protein 4: 지방세포에서 분비되는 단백질입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 Angiopoietin like protein 4의 생성이 증가합니다. Angiopoietin like protein 4는 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- BAIBA: 췌장에서 분비되는 단백질입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 BAIBA의 생성이 증가합니다. BAIBA는 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- Catecholamines: 부신에서 분비되는 호르몬입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 Catecholamines의 생성이 증가합니다. Catecholamines은 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- FGF21: 간에서 분비되는 호르몬입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 FGF21의 생성이 증가합니다. FGF21은 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- GDF15: 근육에서 분비되는 단백질입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 GDF15의 생성이 증가합니다. GDF15는 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- HSP72: 열 충격 단백질의 일종으로서, 세포 손상을 예방하고 회복하는 데 도움이 됩니다. 운동을 하면 HSP72의 생성이 증가합니다. HSP72는 지방세포의 손상을 예방하고 회복하는 데 도움이 됩니다.
- IL-6, 7, 15: 염증성 사이토카인으로서, 지방 분해에 관여하는 물질입니다. 운동을 하면 IL-6, 7, 15의 생성이 증가합니다. IL-6, 7, 15는 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- Irisin: 근육에서 분비되는 단백질입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 Irisin의 생성이 증가합니다. Irisin은 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- METRNL:근육에서 분비되는 단백질입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 METRNL의 생성이 증가합니다. METRNL은 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- Myonectin: 근육에서 분비되는 단백질입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 Myonectin의 생성이 증가합니다. Myonectin은 지방세포의 지방산 방출을 촉진하여 체중 감량에 도움이 됩니다.
- TGFb2: 세포 성장과 분화에 관여하는 단백질입니다. 지방 분해를 촉진하는 물질입니다. 운동을 하면 TGFb2의 생성이 증가합니다. TGFb2는 지방세포의 지방산 방출을 촉진하여 체
심혈관계관련 약물
- 12, 13-diHOME: 혈관의 확장을 촉진하는 물질입니다. 운동을 하면 12, 13-diHOME의 생성이 증가합니다. 12, 13-diHOME은 혈관의 탄력을 향상시키고, 혈액 순환을 개선하는 데 도움이 됩니다.
- Adiponectin: 혈관의 확장을 촉진하는 물질입니다. 운동을 하면 adiponectin의 생성이 증가합니다. adiponectin은 혈관의 탄력을 향상시키고, 혈액 순환을 개선하는 데 도움이 됩니다.
- Angiopoietin 1: 혈관의 신생을 촉진하는 물질입니다. 운동을 하면 Angiopoietin 1의 생성이 증가합니다. Angiopoietin 1은 혈관의 손상을 복구하고, 혈액 순환을 개선하는 데 도움이 됩니다.
- Fractalkine: 혈관의 신생을 촉진하는 물질입니다. 운동을 하면 Fractalkine의 생성이 증가합니다. Fractalkine은 혈관의 손상을 복구하고, 혈액 순환을 개선하는 데 도움이 됩니다.
- FGF21: 혈관의 확장을 촉진하는 물질입니다. 운동을 하면 FGF21의 생성이 증가합니다. FGF21은 혈관의 탄력을 향상시키고, 혈액 순환을 개선하는 데 도움이 됩니다.
- IL-8: 혈관의 신생을 촉진하는 물질입니다. 운동을 하면 IL-8의 생성이 증가합니다. IL-8은 혈관의 손상을 복구하고, 혈액 순환을 개선하는 데 도움이 됩니다.
- Myonectin: 혈관의 확장을 촉진하는 물질입니다. 운동을 하면 Myonectin의 생성이 증가합니다. Myonectin은 혈관의 탄력을 향상시키고, 혈액 순환을 개선하는 데 도움이 됩니다.
- Musclin: 혈관의 신생을 촉진하는 물질입니다. 운동을 하면 Musclin의 생성이 증가합니다. Musclin은 혈관의 손상을 복구하고, 혈액 순환을 개선하는 데 도움이 됩니다.
- VEGF: 혈관의 신생을 촉진하는 물질입니다. 운동을 하면 VEGF의 생성이 증가합니다. VEGF는 혈관의 손상을 복구하고, 혈액 순환을 개선하는 데 도움이 됩니다.
간관련 약물
- BAIBA: 간에서도 분비되는 단백질입니다. 간 기능을 보호하고, 노화로 인한 간 손상을 예방하는 데 도움이 됩니다. 운동을 하면 BAIBA의 생성이 증가합니다.
- Catecholamines: 부신에서 분비되는 호르몬입니다. 간 기능을 보호하고, 노화로 인한 간 손상을 예방하는 데 도움이 됩니다. 운동을 하면 Catecholamines의 생성이 증가합니다.
- IL-6: 염증성 사이토카인입니다. 간 기능을 보호하고, 노화로 인한 간 손상을 예방하는 데 도움이 됩니다. 운동을 하면 IL-6의 생성이 증가합니다.
- Lactate: 운동 중에 근육에서 생성되는 물질입니다. 간에서 대사되어 에너지로 사용됩니다. 운동을 하면 Lactate의 생성이 증가합니다. Lactate는 간 기능을 보호하고, 노화로 인한 간 손상을 예방하는 데 도움이 됩니다.
- Myonectin: 근육에서 분비되는 단백질입니다. 간 기능을 보호하고, 노화로 인한 간 손상을 예방하는 데 도움이 됩니다. 운동을 하면 Myonectin의 생성이 증가합니다.
리프로그래밍 (Cellular Reprogramming)
리프로그래밍은 세포의 유전적 및 기능적 상태를 변경하여 특정 세포 유형에서 다른 세포 유형으로 전환시키는 과정을 의미합니다. 이 방법을 사용하면 특정한 성숙한 세포 유형(예: 피부 세포)을 다른 세포 유형(예: 신경 세포)이나 줄기 세포로 변환시킬 수 있습니다.
배경
2006년, 야마나카 신야 박사와 그의 연구팀은 피부 세포를 유도 다능성 줄기세포(iPSCs, induced pluripotent stem cells)로 전환시키기 위해 4가지 특정 유전자를 사용하는 방법을 발표하였습니다. 이 유전자들은 Oct4, Sox2, Klf4 및 c-Myc로 알려져 있습니다. 이후, 이 연구는 줄기 세포 연구와 재생 의학에 큰 변화를 가져왔습니다.
메커니즘
리프로그래밍은 세포의 유전자 발현 패턴을 변경하여 세포의 운명을 바꾸게 됩니다. 이는 특정 유전자를 활성화하거나 비활성화하여 세포의 특성을 변경시키는 것을 포함합니다.
응용
- 재생 의학: 세포 리프로그래밍 기술을 사용하여 환자 자신의 세포에서 줄기 세포를 만들어 대체 조직이나 장기를 생성하는 데 사용될 수 있습니다.
- 질병 모델링: 환자로부터 얻은 세포를 iPSCs로 리프로그래밍한 뒤, 특정 세포 유형(예: 신경 세포)으로 분화시켜 질병을 연구할 수 있습니다.
- 약물 테스트: iPSCs를 사용하여 특정 세포 유형을 대량 생산하고, 그 세포들에 약물을 테스트하여 안전성 및 효과성을 평가할 수 있습니다.
제한 및 도전 리프로그래밍은 여전히 몇 가지 제한적인 측면들과 직면하고 있습니다. 예를 들어, 리프로그래밍을 통해 생성된 줄기 세포의 품질과 안전성, 그리고 그것들이 인체에서 어떻게 작용하는지에 대한 깊은 이해가 필요합니다. 또한, 리프로그래밍 과정 중에 발생할 수 있는 돌연변이나 에피게네틱스 변화도 주요 고려 사항 중 하나입니다.
요약하면, 세포 리프로그래밍은 현대 의학과 생물학에서 가장 혁신적인 발견 중 하나로 간주되며, 그것의 잠재적인 응용 분야는 광범위합니다.
H3k27ac
H3K27ac는 히스톤 H3 단백질의 27번째 라이신 (K) 위치에서 아세틸화(acetylation) 된 형태를 나타내는 표시입니다. 히스톤 수정은 크로마틴 구조와 표현형에 큰 영향을 미치는 중요한 요소입니다. 아래에는 H3K27ac에 대한 몇 가지 주요 내용을 정리해봤습니다:
- 히스톤 아세틸화: 히스톤 아세틀 전이 효소(histone acetyltransferases, HATs)는 히스톤의 라이신 잔기에 아세틸 그룹을 첨가하는 반면, 히스톤 디아세틸화 효소(histone deacetylases, HDACs)는 아세틸 그룹을 제거합니다. 이러한 아세틸화 및 디아세틸화는 유전자의 발현을 조절하는 데 중요한 역할을 합니다.
- 유전자 활성화의 표시: H3K27ac는 대체로 활성 크로마틴 영역과 연결되어 있습니다. 이는 유전자가 활성 상태라는 것을 나타내는 표시 중 하나로 간주됩니다. 특히, 활성화된 트랜스크립션 시작 지점 주변에 자주 발견됩니다.
- H3K27me3와의 관계: H3K27ac와 대조적으로 H3K27me3 (H3의 27번째 라이신에서 트리메틸화된 형태)는 유전자 발현을 억제하는 크로마틴 표시로 간주됩니다. 이 두 수정 사이의 균형은 유전자의 활성 상태를 결정하는 데 중요합니다.
- 히스톤 코드 가설: 히스톤 코드 가설은 다양한 히스톤 수정들이 복잡한 ‘코드’로 작동하여 특정 유전자의 발현, DNA 복구, 크로마틴 구조 조절 등의 세포 과정을 조절한다는 개념입니다. H3K27ac는 이러한 코드의 일부로 작동합니다.
- 연구의 중요성: H3K27ac는 다양한 생물학적 과정과 질병, 특히 암과 같은 병의 발병에서의 역할을 연구하는 데 중요합니다. 이를 통해, 유전자 조절 메커니즘에 대한 깊은 이해와 질병 치료 전략의 개발이 가능해집니다.
H3K27ac는 유전자 조절, 크로마틴 구조, 그리고 특히 유전자의 활성화 상태와 관련하여 주요한 히스톤 수정 중 하나입니다. 이러한 아세틸화 패턴을 연구함으로써, 우리는 유전자 발현의 복잡한 조절 메커니즘을 더 잘 이해할 수 있습니다.
H3K27me3
H3K27me3는 히스톤 H3 단백질의 27번째 라이신(K) 위치에서 트리메틸화 (trimethylation) 된 형태를 나타냅니다. H3K27me3는 크로마틴 구조와 관련된 주요한 히스톤 수정 중 하나로, 특히 유전자의 발현 억제와 관련되어 있습니다.
H3K27me3에 관한 주요 특징과 중요성에 대해 다음과 같이 요약할 수 있습니다:
- 유전자 억제의 표시: H3K27me3는 주로 히스톤 코드 내에서 유전자 발현의 억제와 관련된 히스톤 수정으로 알려져 있습니다. 이 수정은 유전자의 발현을 억제하는 크로마틴 영역에 풍부하게 발견됩니다.
- Enzymatic Regulation: H3K27me3의 형성은 주로 Polycomb Repressive Complex 2 (PRC2)의 한 구성 요소인 EZH2라는 효소에 의해 중개됩니다. 반면, 이 히스톤 수정의 제거는 특정 히스톤 데메틸화 효소들에 의해 이루어집니다.
- 발달과 분화: H3K27me3는 다양한 세포 발달 및 분화 과정에서 중요한 역할을 합니다. 특히 줄기세포와 발달 중인 세포에서 특정 유전자 집합의 발현을 조절함으로써 발달과 분화를 지원합니다.
- 질병과의 관련성: 잘못된 H3K27me3 패턴은 다양한 질병, 특히 암과 연관될 수 있습니다. 예를 들어, EZH2의 과발현이나 돌연변이는 특정 종류의 암에서 흔히 관찰됩니다.
- H3K27ac와의 대조: 앞서 언급했듯이, H3K27ac는 유전자의 활성화와 관련된 히스톤 수정입니다. 따라서 H3K27me3와 H3K27ac 사이의 균형은 특정 유전자 영역의 크로마틴 상태와 연결되며, 그 결과 유전자의 발현 상태를 결정합니다.
- 히스톤 코드 가설: H3K27me3는 다양한 히스톤 수정과 결합하여 “히스톤 코드”를 형성하는 데 기여합니다. 이 코드는 유전자의 발현, DNA 복구 및 크로마틴 구조와 같은 세포 내 여러 과정을 조절하는 메커니즘의 일부입니다.
H3K27me3는 크로마틴 구조와 유전자 발현의 조절에서 중요한 역할을 하는 히스톤 수정입니다. 이 수정의 연구는 유전자 조절 및 관련 질병, 특히 암의 발병과 진행에 대한 이해를 향상시키는 데 중요합니다.
세포노화(Cellular senescence)
- 주변의 세포를 노화시키는 좀비세포
- 장기를 통해 이동전염
- 텔로미어 고갈 : 유지가 어렵고 암으로 발생할 확률이 있다.
- DNA 손상
- 종양유전자
- 바이러서(코비드)
세포 노화(Cellular senescence)는 세포가 더 이상 분열을 수행하지 못하게 되는 상태를 의미합니다. 세포 노화는 여러 원인과 기전으로 인해 발생하며, 그 결과로 생기는 물리적, 생화학적 특성이 있습니다. 또한 세포 노화는 조직의 노화, 질병의 발생 및 진행, 그리고 생체의 수명에 영향을 미칩니다.
세포 노화에 관한 다음의 주요 내용
- 발생 원인:
- DNA 손상: 연속적인 DNA 손상은 세포 노화의 주요 원인 중 하나입니다. DNA 복구 메커니즘의 실패 또는 오류가 누적되면 세포는 안전하게 분열을 멈춥니다.
- 텔로미어 단축: 텔로미어는 염색체 끝의 반복적인 DNA 구조로, 세포가 분열될 때마다 짧아집니다. 텔로미어가 너무 짧아지면 세포는 노화 상태로 들어갑니다.
- 산화적 스트레스: 과도한 자유 라디칼이 세포 내에서 생성되면 DNA, 단백질, 지질에 손상을 줄 수 있습니다. 이로 인해 세포 노화가 촉진될 수 있습니다.
- 세포 노화의 특성:
- 분열 능력의 손실: 가장 대표적인 특성은 세포가 더 이상 분열하지 않는 것입니다.
- 세포 크기의 증가: 노화된 세포는 종종 정상 세포보다 크기가 큽니다.
- 세네센스-연관된 베타-갈락토시다제 (SA-β-gal) 활성 증가: 이것은 세포 노화의 생화학적 표지자로 자주 사용됩니다.
- 변경된 분비형상: 노화된 세포는 다양한 단백질과 사이토카인을 분비하며, 이로 인해 주변 환경에 영향을 미칠 수 있습니다.
- 세포 노화의 생물학적 중요성:
- 조직 노화 및 기능 장애: 세포 노화는 조직의 노화와 기능 저하에 기여합니다.
- 암 억제: 초기 단계에서는 노화된 세포는 암 발병을 방지하는 데 도움을 줍니다. 이는 손상된 DNA를 가진 세포가 분열을 중단하기 때문입니다.
- 염증과 병의 진행: 오랜 시간 동안 노화된 세포가 조직에 머물게 되면, 이는 염증 반응을 유발하고 다양한 질병의 발생 및 진행에 영향을 줄 수 있습니다.
노화세포 치료 및 중재
- 노화세포제거 약물(Senescent cell accumulation-development of chronic diseases and disorders)
- 노화세포 예방 백신(Senolytic interventions)
세포 노화와 관련된 병의 진행을 줄이기 위해 여러 연구가 진행되고 있습니다. 예를 들어, 세네올리틱제(senolytics)는 특정 노화 세포를 표적으로 하여 제거하는 약물입니다.
약물로 제어하는 방법
Dasatinib
원래 만성 골수성 백혈병(CML)과 급성 림프모구성 백혈병(ALL) 치료를 위해 개발된 약물입니다. 최근 연구에서는 Dasatinib이 노화 세포(senescence cells)를 제거하는 데 효과적일 수 있다는 것이 밝혀지고 있습니다. 이러한 노화 세포 제거 효과는 만성 질환의 예방 및 치료, 그리고 노화 과정을 늦추는 데 도움이 될 수 있습니다. 하지만 Dasatinib을 노화 관련 치료제로 사용하기 위해서는 추가적인 연구와 임상 시험이 필요합니다.
Quercetin
식물에서 자연적으로 발견되는 플라보노이드로, 강력한 항산화 및 항염증 효과가 있습니다. 최근의 연구에서는 Quercetin이 노화 세포를 제거하는 데 도움이 될 수 있다는 것이 밝혀졌습니다. 노화 세포 제거는 노화 과정을 늦추고, 만성 질환의 위험을 감소시킬 수 있는 잠재력을 가지고 있습니다. Quercetin은 일반적으로 사과, 양파, 포도, 녹차 등 여러 식품에서 찾을 수 있으며, 건강 보조식품으로도 널리 사용됩니다.
Fisetin
천연 플라보노이드 화합물로, 주로 과일과 채소에서 발견됩니다. Fisetin은 최근 노화 연구에서 주목받고 있으며, 특히 노화 세포 제거에 효과적일 수 있다는 연구 결과가 나타나고 있습니다. 노화 세포는 더 이상 분열하지 않으며 염증을 유발하고 조직 기능을 저하시키는데, Fisetin은 이러한 노화 세포를 제거하고 노화 과정을 늦추며 만성 질환의 위험을 감소시킬 수 있을 것으로 기대됩니다. 그러나 Fisetin을 노화 방지나 치료제로 사용하기 위해서는 추가적인 연구와 임상 시험이 필요합니다.
잠재적 응용
D : Ephrin/dependence CDKN1A
Ephrin과 CDKN1A(사이클린 의존성 키나제 억제제 1A, 또는 p21)는 세포 신호 전달 및 세포주기 조절에 중요한 역할을 합니다. CDKN1A는 세포주기를 조절하고 세포의 노화 및 사멸 과정에 관여하는 단백질입니다. 이 단백질은 세포의 무분별한 성장을 억제하고, DNA 손상이 있을 때 세포주기를 일시적으로 멈추게 하는 기능을 합니다. Ephrin은 세포 간 상호작용과 위치 결정에 관여하며, 이 두 단백질은 세포의 노화, 세포 사멸, 암 발생 등 다양한 생물학적 과정에 중요한 역할을 합니다.
Q : PIK3CD; HIF1a; SERPINE1
PIK3CD, HIF1a, 및 SERPINE1은 각각 다른 생물학적 경로에서 중요한 역할을 하는 유전자입니다:
- PIK3CD (Phosphoinositide-3-Kinase Catalytic Delta): PIK3CD는 세포 성장, 분열, 생존에 중요한 신호 전달 경로인 PI3K/AKT 경로의 일부입니다. 이 유전자의 변이는 면역 결핍과 관련된 질병을 유발할 수 있습니다.
- HIF1a (Hypoxia-Inducible Factor 1-Alpha): HIF1a는 저산소 상태에서 활성화되며, 세포의 산소 환경에 대한 반응을 조절합니다. 암과 같은 질병에서 HIF1a는 종양의 성장과 전이에 중요한 역할을 합니다.
- SERPINE1 (Serpin Family E Member 1): SERPINE1은 혈액 응고 및 섬유소 용해 과정에서 주요한 역할을 합니다. 이 유전자는 혈액 응고 장애와 관련된 질병에 중요한 역할을 합니다.
D+Q: SERPINEB2; BCL2L1
SERPINE2와 BCL2L1은 두 개의 중요한 생물학적 유전자입니다:
- SERPINE2 (Serpin Family E Member 2): SERPINE2는 혈액 응고 및 조직 재생 과정에서 중요한 역할을 하는 단백질을 코딩합니다. 이 유전자는 혈액 응고 장애와 관련된 질환, 염증 반응, 그리고 섬유화 과정에 영향을 미칠 수 있습니다.
- BCL2L1 (BCL2 Like 1): BCL2L1은 세포 사멸(아포토시스)를 조절하는 유전자로, BCL-2 단백질 가족의 일부입니다. 이 유전자는 세포의 생존과 사멸을 조절하는 데 중요한 역할을 하며, 암 발생 및 치료에도 관련이 있습니다.
Dasatinib의 세포노화 유도 효과는 다양한 질병의 치료에 적용될 수 있을 것으로 기대됩니다. 예를 들어, Dasatinib은 암, 섬유증, 퇴행성 신경 질환 등의 치료에 사용될 수 있습니다. 이들 단백질 및 유전자들은 세포의 생존, 세포 주기, 응고, 염증 및 다른 중요한 생물학적 과정에 관여합니다. Dasatinib와 같은 약물이 이들 경로를 어떻게 영향을 미치는지에 대한 연구는 이해하는 데 중요하며, 암 치료와 관련된 다른 전략을 개발하는 데 도움이 될 수 있습니다.
면역세포 회피
면역세포 회피 메커니즘은 암세포나 노화 세포가 면역 시스템의 감지를 피하는 방법을 말합니다. 이러한 세포들은 큰 손상을 입었을 때 노화 세포로 변하거나 정상 세포처럼 위장하여 면역 체계의 공격으로부터 숨을 수 있습니다. 연구자들은 이런 노화 세포를 표적으로 하는 백신을 개발하여 노화와 관련된 질병을 예방하고 치료하는 방법을 연구하고 있습니다. 이 백신은 노화 미세 환경을 변화시켜 노화 세포를 제거하고, 이를 통해 노화의 회복을 촉진할 수 있습니다.
mRNA 기술에 관해서는, nucleoside-modified mRNA, unmodified mRNA, 그리고 self-amplifying mRNA, circular mRNA 등 다양한 형태의 mRNA가 연구되고 있습니다. 이들은 각각 다른 방식으로 면역 반응을 유도하고, 유전자 표현을 조절하는 데 사용될 수 있습니다.
세포가 큰 손상을 입으면 노화세포로 변경
세포가 큰 손상을 입었을 때 노화 세포(senescent cells)로 변하는 현상은 세포의 자가보호 메커니즘의 일부입니다. 세포 노화는 DNA 손상, 산화적 스트레스, 염증, 대사적 스트레스 등으로 인해 발생할 수 있으며, 이는 세포가 더 이상 분열하지 않고 활성화된 상태로 남아있는 것을 의미합니다. 이러한 노화 세포들은 주변 조직에 염증 반응을 유발하고, 조직 손상을 촉진할 수 있으며, 노화 및 다양한 질병의 발달에 기여할 수 있습니다.
노화 세포는 정상 세포인척 숨으려고 함
노화 세포가 정상 세포처럼 숨으려 하는 현상은 면역 시스템으로부터 자신을 보호하기 위한 것입니다. 이러한 세포는 면역 시스템에 의해 식별되고 제거되는 것을 피하기 위해, 정상 세포와 유사한 신호를 보내는 방식으로 위장할 수 있습니다. 이는 노화 세포의 제거를 어렵게 만들고, 결과적으로 염증 반응, 조직 손상, 그리고 만성 질환의 위험을 증가시킬 수 있습니다. 이러한 메커니즘을 이해하는 것은 노화와 관련된 질병을 치료하는 데 중요한 역할을 합니다.
노화연구: 노화세포 예방 백신등
노화세포 예방 백신(연구중)⇒ 노화미세환경 ⇒ 노화세포제거 ⇒ 노화회복
Nucleoside-modified mRNA
mRNA 기반 치료제와 백신의 개발에 사용되는 기술입니다. 이 기술에서는 mRNA의 일부 nucleoside를 변형시켜 면역 반응을 증가시키고 mRNA의 안정성을 향상시킵니다. 이러한 수정은 mRNA를 인체의 세포에 더 효과적으로 전달하고, 세포 내에서 원하는 단백질의 생산을 촉진하는 데 도움이 됩니다. Nucleoside-modified mRNA 기술은 COVID-19 백신 개발에서 중요한 역할을 했으며, 이 기술의 응용은 다양한 질병에 대한 치료제 개발에 중요한 가능성을 가지고 있습니다.
Unmodified mRNA ⇒ Self-amplyfying mRNA
그대로의 형태로 사용되는 mRNA를 말하며, 특정 단백질을 생산하기 위해 세포로 전달됩니다. 반면, Self-amplifying mRNA는 자체 복제 능력을 가진 특수한 형태의 mRNA입니다. 이는 세포 내에서 스스로를 복제하고 더 많은 단백질을 생산할 수 있도록 설계되었습니다. 이러한 기술은 백신과 치료제 개발에 특히 유용하며, 더 적은 양의 mRNA를 사용하여 동일한 수준의 면역 반응을 유도할 수 있는 잠재력을 가지고 있습니다.
Circular mRNA
선형 구조 대신 고리 형태를 가진 mRNA입니다. 이 구조는 mRNA의 안정성을 크게 향상시키며, 분해를 늦추는 역할을 합니다. Circular mRNA는 세포 내에서 더 오랜 시간 동안 존재할 수 있으므로, 단백질 생산을 지속적으로 촉진할 수 있습니다. 이러한 특성은 치료제 개발, 특히 유전자 치료 및 백신 개발에서 중요한 응용 가능성을 가지고 있습니다.
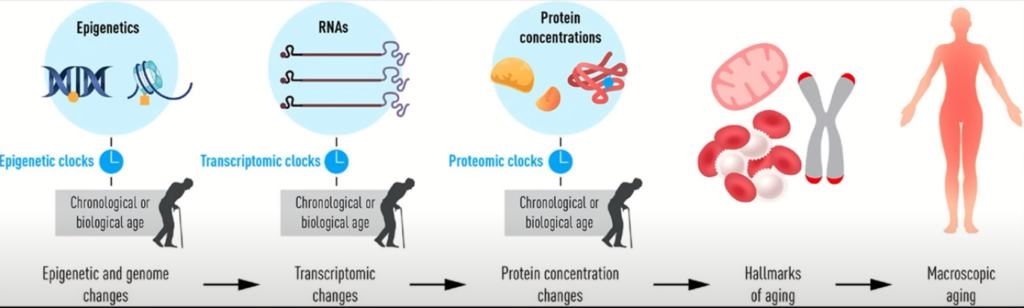
생체노화 속도
생체 노화 속도는 다음과 같은 연속된 단계를 거쳐 나타납니다:
- Epigenetic and Genome Changes: 노화 과정은 유전자의 메틸화 변화, 히스톤 수정, 크로마틴 구조 변화 등의 후성유전학적 변화로 시작됩니다. 이러한 변화는 유전자의 발현을 조절하고, DNA 손상의 누적과 같은 유전체 변화를 유발할 수 있습니다.
- Transcriptomic Changes: 후성유전학적 및 유전체 변화는 RNA 발현 패턴을 변화시킵니다. 이는 특정 유전자의 발현 증가나 감소로 이어지며, 세포 기능 및 생리학적 과정에 영향을 미칩니다.
- Protein Concentration Changes: RNA의 변화는 단백질의 농도와 종류에 영향을 미칩니다. 노화와 관련된 단백질의 변화는 세포의 대사, 수리 메커니즘, 신호 전달 경로 등에 영향을 줄 수 있습니다.
- Hallmarks of Aging: 이러한 분자적 변화는 노화의 여러 특징, 즉 DNA 손상 누적, 염증 반응 증가, 세포 사멸과 노화, 줄기 세포 기능 감소 등을 초래합니다.
- Macroscopic Aging: 마지막으로, 이러한 분자 및 세포 수준의 변화는 조직 및 기관의 기능 저하, 신체적 노화 징후, 그리고 건강상의 문제로 이어지며 전반적인 생체 노화를 나타냅니다.
이러한 연속된 과정을 통해 생체 노화는 다양한 분자적, 세포적, 조직적 수준에서 진행되며, 이는 개인의 노화 속도와 건강 상태에 영향을 미칩니다.
후성유전체
후성유전체(Biological Epigenome)는 생물학적 맥락에서 DNA 서열 변화 없이 유전자의 발현을 조절하는 모든 후성유전적 변화를 말합니다. 이는 DNA 메틸화, 히스톤 변형, 크로마틴 구조 변화 등을 포함하며, 이러한 메커니즘은 유전자의 발현을 조절하여 세포의 기능, 발달 과정, 노화, 질병 발생과 같은 중요한 생물학적 과정에 영향을 미칩니다. 후성유전체의 변화는 환경적 요인, 생활 습관, 질병 상태 등에 의해 영향을 받을 수 있습니다.
후성유전체 시계(Biological clock)
후성유전체 시계(Biological Epigenetic Clock)는 생물학적 나이와 관련된 유전자의 후성유전적 변화를 측정하는 방법입니다. 이 시계는 DNA 메틸화 패턴의 변화를 분석하여 개인의 생물학적 나이를 추정합니다. DNA 메틸화 수준은 나이, 환경적 요인, 생활 습관 등에 따라 변화하며, 이를 분석함으로써 노화 과정, 질병 위험, 심지어 수명 예측에 중요한 정보를 제공할 수 있습니다. 후성유전체 시계는 노화 연구, 질병 예측 및 예방, 건강 관리에서 중요한 도구로 활용됩니다.
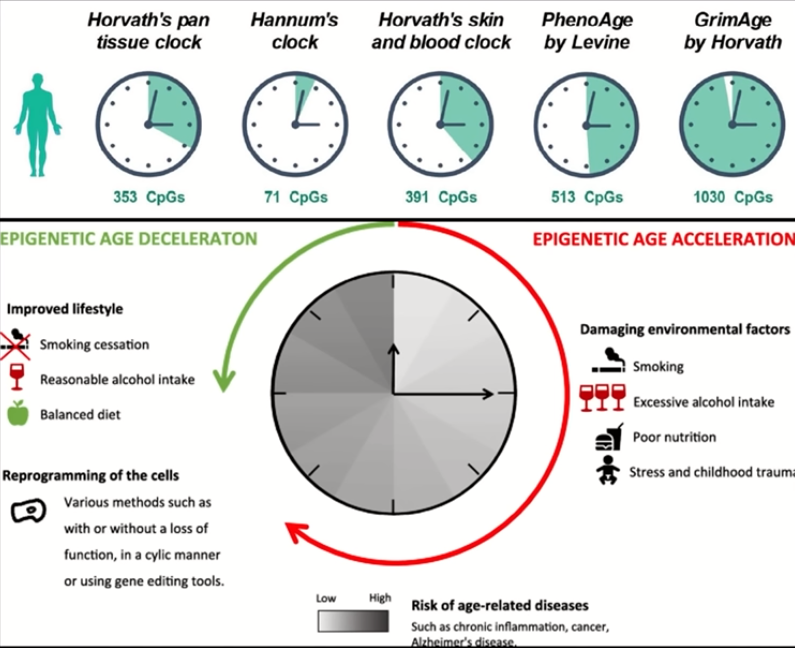
결론
노화는 질병이다 아니다
질병코드 : MG2A-Old age 시도 했으나 실패
노화를 ‘질병’으로 간주할지 여부는 과학 및 의학 분야에서 여전히 논쟁의 대상입니다. 일부 과학자들은 노화가 다양한 생물학적 과정의 결과로 나타나는 자연스러운 현상이라고 주장하며, 이를 일반적인 생명 주기의 일부로 간주합니다. 반면, 다른 이들은 노화를 질병의 일종으로 보고, 이를 치료하고 관리할 수 있는 의학적 조건으로 간주합니다. 이러한 관점은 노화 과정을 어떻게 이해하고 대응할 것인가에 대한 중요한 논쟁을 제기하며, 노화 연구 및 치료 전략의 발전에 영향을 미칩니다.
노화연구의 미래
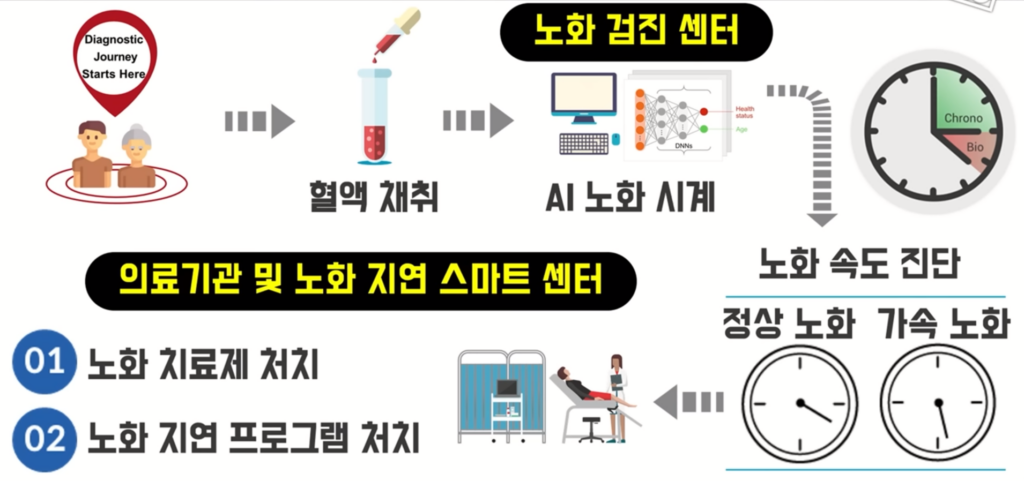
노화 연구의 미래는 다음과 같은 순서로 진행될 수 있습니다:
- 혈액 채취: 개인의 혈액 샘플을 통해 생물학적 데이터를 수집합니다.
- AI 노화 시계: 인공지능을 이용하여 혈액 샘플에서 수집된 데이터를 분석하고, 개인의 생물학적 나이 및 노화 속도를 측정합니다.
- 노화 속도 진단: AI 분석 결과를 바탕으로 개인의 노화 속도가 정상인지, 가속되고 있는지를 진단합니다.
- 치료 전략 결정:
- 정상 노화: 예방적 건강 관리 및 생활 습관 개선 프로그램을 제공합니다.
- 가속 노화: 노화 치료제 처치나 맞춤형 노화 지연 프로그램을 적용하여 노화 과정을 늦추고 건강 상태를 개선합니다.
이러한 접근 방식은 개인별 맞춤 의료와 예방적 건강 관리에 중요한 역할을 할 것으로 기대됩니다.